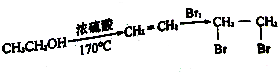题目内容
6.下列化学反应中,HCl部分被氧化的是( )| A. | NaOH+HCl=NaCl+H2O | B. | 4HCl+MnO2=Cl2↑+MnCl2+2H2O | ||
| C. | HCl+AgNO3=AgCl↓+HNO3 | D. | CaO+2HCl=CaCl2+H2O |
分析 HCl部分被氧化,则Cl元素的化合价部分升高,部分不变生成盐,以此来解答.
解答 解:A、C、D中均没有元素的化合价变化,均不存在HCl被氧化,
只有B中生成氯气时HCl被氧化,生成氯化锰时体现其酸性,符合HCl部分被氧化,
故选B.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,注意元素的化合价升高被氧化,题目难度不大.

练习册系列答案
相关题目
16.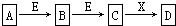 中学常见物质A、B、C、D、E、X,存在如图转化关系(部分生成物和反应条件略去).下列推断不正确的是( )
中学常见物质A、B、C、D、E、X,存在如图转化关系(部分生成物和反应条件略去).下列推断不正确的是( )
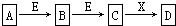 中学常见物质A、B、C、D、E、X,存在如图转化关系(部分生成物和反应条件略去).下列推断不正确的是( )
中学常见物质A、B、C、D、E、X,存在如图转化关系(部分生成物和反应条件略去).下列推断不正确的是( )| A. | 若D是一种白色沉淀,在空气中最终变为红褐色,则A可能是铁 | |
| B. | 若D是一种强碱,则A、B、C均可与X反应生成D | |
| C. | 若D为NaCl,且A可与C反应生成B,则E可能是CO2 | |
| D. | 若D是一种强酸且可与铜反应生成B或C,则A既可以是单质也可以是化合物 |
17.下列有关有机物结构的叙述不正确的是( )
| A. | 一氟一氯甲烷只有一种结构,可以证明甲烷是正四面体结构 | |
| B. | 甲烷、乙烯和苯分子中所有原子都在同一个平面上 | |
| C. | 乙酸分子中含有羧基,可与NaHCO3溶液反应生成CO2 | |
| D. | 1 mol乙醇与足量的钠反应生成0.5 mol氢气,可证明乙醇分子中只有一个羟基 |
14.将0.01molNaOH和 0.01molNa2CO3混合并配成溶液,向溶液中滴加0.1mol•L-1稀盐酸.下列图象能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
| A. | 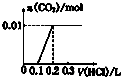 | B. | 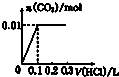 | C. | 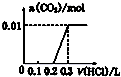 | D. | 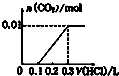 |
11.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | pH=12的溶液:NO3-、I-、Na+、Al3+ | |
| B. | 0.1mol.L-1CH3COONa溶液:Mg2+、H+、Cl-、SO42- | |
| C. | Kw/c(H+)=0.1mol•L-1 的溶液:Na+、K+、SiO32-、NO3- | |
| D. | 0.1mol•L-1KMnO4溶液:Na+、Mg2+、N03-、S032- |
15.金矿污水中含氰化物和铅、汞等重金属元素.氰气[(CN)2]和氰化物都是剧毒性物质.氰气分子的结构式为N≡C-C≡N,性质与卤素相似,下列叙述不正确的是( )
| A. | 氰分子中四原子共直线,是含有极性键的非极性分子 | |
| B. | 氰分子中碳氰三键键长大于乙炔中碳碳三键键长,所以氰气更容易和氢气加成 | |
| C. | 氰气能与强碱溶液反应得到氰化物和次氰酸盐 | |
| D. | 氰分子中σ键和π键的个数比为3:4 |
1.关于反应速率的说法中,正确的是( )
| A. | 反应速率用于衡量化学反应进行的快慢 | |
| B. | 决定反应速率的本质因素是反应温度 | |
| C. | 可逆反应达到化学平衡时,正逆反应速率都为0 | |
| D. | 增加反应物物质的量,能增大反应速率 |
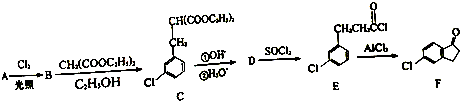
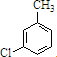 ,反应D→E的反应类型取代反应.
,反应D→E的反应类型取代反应.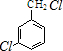 +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$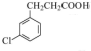 ,某化学物是D的同分异构体,能使FeCl3溶液显紫色,且分子中只有3种不同化学环境的氢,写出该化合物的结构简式:
,某化学物是D的同分异构体,能使FeCl3溶液显紫色,且分子中只有3种不同化学环境的氢,写出该化合物的结构简式: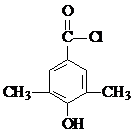 或
或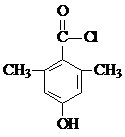 (任写一种).
(任写一种).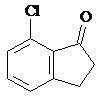 .
.