题目内容
【题目】有关物质的量的计算是中学化学的重要部分,请按要求填空:
(1)2molO2和__gCH4在标准状况下占有相同的体积,其体积为___L。
(2)标况下,现有96g的氧气和44.8升的二氧化碳两者的密度之比为___;两者的体积之比为___。
(3)将等物质的量的NH3和CH4混合,混合气体中NH3与CH4的质量比为___。
(4)要使NH3与CH4含相同数目的H原子,则NH3和CH4的物质的量之比为___。
(5)在某温度下,NaOH的溶解度为20g,该温度下将80gNaOH投入220g水中,充分搅拌后,测得溶液的密度为1.2g/mL,则该溶液中溶质的物质的量浓度为___。
【答案】32 44.8 8:11 3:2 17:16 4:3 5mol/L
【解析】
(1)根据V=nVm知,相同状况下,气体的体积比等于物质的量之比,则甲烷的物质的量为2mol,则甲烷的质量为m=nM=2mol×16g/mol=32g,其体积V=nVm=2mol×22.4L/mol=44.8L;
故答案为:32;44.8;
(2)气体的密度![]() ,同温同压下,气体物质有以下关系
,同温同压下,气体物质有以下关系![]() ,则氧气和二氧化碳的密度之比为32:44=8:11;氧气的物质的量为
,则氧气和二氧化碳的密度之比为32:44=8:11;氧气的物质的量为![]() ,二氧化碳物质的量为
,二氧化碳物质的量为![]() ,相同状况下,气体的体积比等于物质的量之比,则氧气与二氧化碳的体积比为3:2;
,相同状况下,气体的体积比等于物质的量之比,则氧气与二氧化碳的体积比为3:2;
故答案为:8:11;3:2;
(3)由m=nM知,等物质的量的NH3和CH4的质量比等于其摩尔质量之比,为17:16;
故答案为:17:16;
(4)设NH3和CH4的物质的量分别为x mol、y mol,由分子的构成及含相同数目的H原子可知,3x=4y,则x:y=4:3,则NH3和CH4的物质的量之比为4:3;
故答案为:4:3;
(5)已知在某温度下,NaOH的溶解度为20g,设220g水溶解x gNaOH,则有:![]() ,解得x=44g,说明溶液过饱和了,所以溶液的质量分数为
,解得x=44g,说明溶液过饱和了,所以溶液的质量分数为![]() ,则该溶液中溶质的物质的量浓度为
,则该溶液中溶质的物质的量浓度为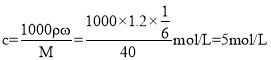 ;
;
故答案为:5mol/L。