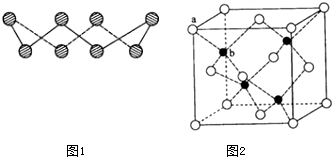
题目内容
9.有关胶体等分散系的制备、性质的相关说法不正确的是( )| A. | 向沸水中逐滴加入FeCl3饱和溶液,继续煮沸至液体呈红褐色,即制得Fe(OH)3胶体 | |
| B. | 向Fe(OH)3胶体中加入稀H2SO4至过量,现象为先生成红褐色沉淀,之后沉淀溶解 | |
| C. | 依据丁达尔效应可将分散系分为溶液、胶体与浊液 | |
| D. | 将Fe(OH)3胶体与硅酸溶胶相互混合,混合液变浑浊 |
分析 A.向沸水中逐滴加入FeCl3饱和溶液,继续煮沸至液体呈红褐色,停止加热;
B.先发生Fe(OH)3胶体的聚沉;
C.溶液、胶体与浊液的本质区别为分散质的直径大小;
D.胶粒遇带相反电荷的胶粒发生聚沉.
解答 解:A.向沸水中逐滴加入FeCl3饱和溶液,继续煮沸至液体呈红褐色,停止加热,制得Fe(OH)3胶体,故A正确;
B.先发生Fe(OH)3胶体的聚沉,H2SO4过量时,Fe(OH)3溶解,故B正确;
C.溶液、胶体与浊液的本质区别为分散质的直径大小,只有胶体具有丁达尔现象,故C错误;
D.硅酸胶体微粒带负电荷,与Fe(OH)3胶体混合将发生聚沉,故D正确.
故选C.
点评 本题考查胶体的性质,为高频考点,侧重于基础知识的理解和应用的考查,难度不大,注意丁达尔效应是胶体的共性.

练习册系列答案
相关题目
20.下列物质的分子组成不符合通式CnH2n-6的是( )
| A. |  | B. |  | C. | 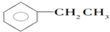 | D. | 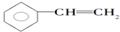 |
17.下列物质中,含氢原子数目最多的是( )
| A. | 9g H2O | B. | 0.3 mol硫酸 | C. | 0.4 mol甲烷 | D. | 0.2 mol磷酸 |
4.下列叙述中,正确的是( )
| A. | 原子晶体中只含有共价键 | |
| B. | 分子晶体中只存在分子间作用力,不存在化学键 | |
| C. | 离子晶体中只含有离子键,不含共价键 | |
| D. | 任何晶体中,若含有阳离子也一定含有阴离子 |
1.在同温同压下,一定量的某有机物和过量的金属钠反应产生aL氢气,另取等量的该有机物与足量的小苏打溶液反应,可以收集二氧化碳气体bL,若a=b,则该有机物可能是( )
| A. | HOOC-CH2-CH2OH | B. | HOOC-CH2-COOH | C. | HOCH2-CH2-CH2OH | D. | CH3-CH2-COOH |
18.已知:Na2SO3在空气中会被氧气氧化成Na2SO4.现将物质的量均为1mol的下述物质,长期放置于空气中(最终物质不考虑潮解情况),最后质量增加的大小关系是( )
①Na2O
②Na2O2
③NaOH
④Na2SO3.
①Na2O
②Na2O2
③NaOH
④Na2SO3.
| A. | ①=③>②>④ | B. | ①>②>④>③ | C. | ③>①=②>④ | D. | ④>③>②>① |
19.K、Ka、KW分别表示化学平衡常数、电离常数和水的离子积,下列判断正确的是( )
| A. | 温度升高,三者都增大 | |
| B. | 室温下K(HCN)<K(CH3COOH),说明CH3COOH的电离度一定比HCN大 | |
| C. | 2SO2(g)+O2(g)?2SO3(g)达平衡后,改变某一条件K值不变,SO2的转化率可能增大、减小或不变 | |
| D. | 平衡常数的大小与温度、浓度、压强、催化剂等有关 |