题目内容
14.ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含ⅥA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题: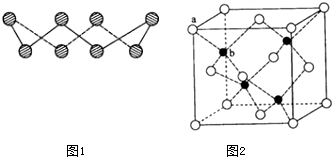
(1)S单质的常见形式为S8,其环状结构如图1所示,S原子采用的轨道杂化方式是sp3;
(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为O>S>Se;
(3)Se原子序数为34,其核外M层电子的排布式为3s23p63d10;
(4)H2Se的酸性比H2S强(填“强”或“弱”).气态SeO3分子的立体构型为平面三角形,SO${\;}_{3}^{2-}$离子的立体构型为三角锥形;
(5)H2SeO3的K1和K2分别为2.7×10-3和2.5×10-8,H2SeO4第一步几乎完全电离,K2为1.2×10-2,请根据结构与性质的关系解释;
①H2SeO4和H2SeO3第一步电离程度大于第二部电离的原因:第一步电离后生成的负离子,较难再进一步电离出带正电荷的氢离子;
②H2SeO4和H2SeO3酸性强的原因:H2SeO3和H2SeO4可表示成(HO)2SeO和(HO)2SeO2.H2SeO3中的Se为+4价,而H2SeO4中的Se为+6价,正电性更高,导致Se-O-H中O的电子更向Se偏移,越易电离出H+;
(6)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛.立方ZnS晶体结构如图2所示,其晶胞边长为540.0pm,密度为4.1g•cm-3(列式并计算),a位置S2-离子与b位置Zn2+离子之间的距离为$\frac{270}{\sqrt{1-cos109°28′}}$pm(列式表示).
分析 (1)根据图片知,每个S原子含有2个σ键和2个孤电子对,根据价层电子对互斥理论确定S原子杂化方式;
(2)同一主族元素,元素原子失电子能力随着原子序数的增大而增强,原子失电子能力越强,其第一电离能越小;
(3)Se元素34号元素,M电子层上有18个电子,分别位于3s、3p、3d能级上;
(4)非金属性越强的元素,其与氢元素的结合能力越强,则其氢化物在水溶液中就越难电离,酸性就越弱;
根据价层电子对互斥理论确定气态SeO3分子的立体构型、SO32-离子的立体构型;
(5)①第一步电离后生成的负离子,较难再进一步电离出带正电荷的氢离子;
②根据中心元素Se的化合价可以判断电性高低,电性越高,对Se-O-H中O原子的电子吸引越强,越易电离出H+;
(6)利用均摊法计算晶胞中Zn、S原子数目,进而计算晶胞质量,再根据ρ=$\frac{m}{V}$计算晶胞密度;
b位置黑色球与周围4个白色球构成正四面体结构,黑色球与两个白色球连线夹角为109°28′,计算a位置白色球与面心白色球距离,设a位置S2-与b位置Zn2+之间的距离,由三角形中相邻两边、夹角与第三边关系:a2+b2-2abcosθ=c2计算.
解答 解:(1)根据图片知,每个S原子含有2个σ键和2个孤电子对,所以每个S原子的价层电子对个数是4,则S原子为sp3杂化,
故答案为:sp3;
(2)同一主族元素,元素原子失电子能力随着原子序数的增大而增强,原子失电子能力越强,其第一电离能越小,所以其第一电离能大小顺序是O>S>Se,
故答案为:O>S>Se;
(3)Se元素34号元素,M电子层上有18个电子,分别位于3s、3p、3d能级上,所以其核外M层电子的排布式为3s23p63d10,
故答案为:34;3s23p63d10;
(4)非金属性越强的元素,其与氢元素的结合能力越强,则其氢化物在水溶液中就越难电离,酸性就越弱,非金属性S>Se,所以H2Se的酸性比H2S强,气态SeO3分子中Se原子价层电子对个数是3且不含孤电子对,所以其立体构型为平面三角形,SO32-离子中S原子价层电子对个数=3+$\frac{1}{2}$(6+2-3×2)=4且含有一个孤电子对,所以其立体构型为三角锥形,
故答案为:强;平面三角形;三角锥形;
(5)①第一步电离后生成的负离子,较难再进一步电离出带正电荷的氢离子,故H2SeO3和H2SeO4第一步电离程度大于第二步电离,
故答案为:第一步电离后生成的负离子,较难再进一步电离出带正电荷的氢离子;
②H2SeO3和H2SeO4可表示成(HO)2SeO和(HO)2SeO2.H2SeO3中的Se为+4价,而H2SeO4中的Se为+6价,正电性更高,导致Se-O-H中O的电子更向Se偏移,越易电离出H+,H2SeO4比H2SeO3酸性强,
故答案为:H2SeO3和H2SeO4可表示成(HO)2SeO和(HO)2SeO2.H2SeO3中的Se为+4价,而H2SeO4中的Se为+6价,正电性更高,导致Se-O-H中O的电子更向Se偏移,越易电离出H+;
(2)晶胞中含有白色球位于顶点和面心,共含有8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,黑色球位于体心,共4个,则晶胞中平均含有4个ZnS,质量为4×(87÷6.02×1023)g,晶胞的体积为(540.0×10-10cm)3,则密度为[4×(87÷6.02×1023)g]÷(540.0×10-10cm)3=4.1g•cm-3;
b位置黑色球与周围4个白色球构成正四面体结构,黑色球与两个白色球连线夹角为109°28′,a位置白色球与面心白色球距离为540.0pm×$\frac{\sqrt{2}}{2}$=270$\sqrt{2}$pm,设a位置S2-与b位置Zn2+之间的距离为y pm,由三角形中相邻两边、夹角与第三边关系:y2+y2-2y2cos109°28′=(270$\sqrt{2}$)2,解得y=$\frac{270}{\sqrt{1-cos109°28′}}$,
故答案为:4.1;$\frac{270}{\sqrt{1-cos109°28′}}$.
点评 本本题考查了较综合,涉及粒子空间构型判断、原子杂化方式判断、元素周期律、晶胞计算等知识,需要学生具备一定的空间想象与数学计算能力,难度较大,答题时注意根据价层电子对互斥理论、元素周期律等知识点来分析解答.

| A. | 氢氧化钠与盐酸反应 OH-+H+=H2O | |
| B. | 用稀硫酸清除铁锈 Fe2O3+6H+=2Fe3++3H2O | |
| C. | 食盐水中滴加硝酸银溶液 Cl-+Ag+=AgCl↓ | |
| D. | 氢氧化钡跟硫酸铜溶液反应 Ba2++SO42-=BaSO4↓ |
| A. | 向沸水中逐滴加入FeCl3饱和溶液,继续煮沸至液体呈红褐色,即制得Fe(OH)3胶体 | |
| B. | 向Fe(OH)3胶体中加入稀H2SO4至过量,现象为先生成红褐色沉淀,之后沉淀溶解 | |
| C. | 依据丁达尔效应可将分散系分为溶液、胶体与浊液 | |
| D. | 将Fe(OH)3胶体与硅酸溶胶相互混合,混合液变浑浊 |
| A. | 金刚石和石墨 | B. | 氨基乙酸和硝基乙烷 | ||
| C. |  和 和 | D. | 甲基丙烯酸和甲酸丙酯 |
| NaOH溶液 | 银氨溶液 | 新制Cu(OH)2悬浊液 | 金属钠 | |
| A | 中和反应 | - | 溶解 | 产生氢气 |
| B | - | 有银镜 | 加热后有砖红色沉淀 | 产生氢气 |
| C | 水解反应 | 有银镜 | 加热后有砖红色沉淀 | - |
| D | 水解反应 | - | - | - |
(2)写出D在NaOH溶液中水解的化学方程式CH3COOCH3+NaOH$→_{△}^{水}$CH3COONa+CH3OH.
| A. | 平衡向正反应方向移动了 | B. | 物质A的转化率增大 | ||
| C. | 物质B的质量分数减小了 | D. | a>b |
 Cl02气体是一种常用的消毒剂,我国从2000年起逐步用Cl02代替氯气对饮用水进行消毒.但二氧化氯是一种极易爆炸的强氧化性气体,易溶于水、不稳定、呈黄绿色,在生产和使用时必须尽量用稀有气体进行稀释,同时需要避免光照、震动或加热.
Cl02气体是一种常用的消毒剂,我国从2000年起逐步用Cl02代替氯气对饮用水进行消毒.但二氧化氯是一种极易爆炸的强氧化性气体,易溶于水、不稳定、呈黄绿色,在生产和使用时必须尽量用稀有气体进行稀释,同时需要避免光照、震动或加热.