题目内容
4.下列叙述中,正确的是( )| A. | 原子晶体中只含有共价键 | |
| B. | 分子晶体中只存在分子间作用力,不存在化学键 | |
| C. | 离子晶体中只含有离子键,不含共价键 | |
| D. | 任何晶体中,若含有阳离子也一定含有阴离子 |
分析 A、原子晶体是原子间通过共价键结合形成的空间网状结构的晶体;
B、分子晶体中,构成分子的原子之间可形成化学键;
C、离子晶体可含有离子键和共价键;
D、金属晶体含有阳离子,但不含阴离子.
解答 解:A、原子晶体是原子间通过共价键结合形成的空间网状结构的晶体,所以原子晶体中只含有共价键,故A正确;
B、分子晶体中,构成分子的原子之间可形成化学键,如H2O含有O-H键,故B错误;
C、离子晶体可含有离子键和共价键,如NaOH,故C错误;
D、金属晶体由金属离子和自由电子构成,含有阳离子,但不含阴离子,故D错误;
故选:A.
点评 本题考查晶体的构成和性质,注意把握组成微粒和粒子间的作用力,侧重于基础知识的考查,难度不大.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目
14.下列实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | SO2通入溴水中 | 溶液褪色 | SO2有漂白性 |
| B | 将Fe(NO3)2样品溶于稀H2SO4,滴加KSCN溶液 | 溶液变红 | Fe(NO3)2样品已氧化变质 |
| C | 取等物质的量的两种金属单质X、Y,分别与足量的盐酸反应 | X产生氢气的体积比Y多 | 金属性:X>Y |
| D | 分别向0.1mol•L-1醋酸和饱和硼酸溶液中滴加0.1mol•L-1Na2CO3溶液 | 醋酸中有气泡产生,硼酸中没有气泡产生 | 酸性:醋酸>碳酸>硼酸 |
| A. | A | B. | B | C. | C | D. | D |
15.下列说法中,正确的是( )
| A. | 配制溶液定容时俯视刻度线将使所配溶液浓度偏低 | |
| B. | 18g H2O在标准状况下的体积为22.4L | |
| C. | 在标准状况下,20mLNH3 与60mLO2所含的分子数比为1:3 | |
| D. | 将40g NaOH溶于1L水中,所得溶液的物质的量浓度为1mol/L |
12.某同学配制一定物质的量浓度的NaOH溶液,下列情况会造成所配溶液浓度偏低的是( )
| A. | 向容量瓶中加水定容时俯视刻度线 | |
| B. | 称量时所用NaOH已经潮解 | |
| C. | 容量瓶中有蒸馏水 | |
| D. | 溶解后未经冷却就转移到容量瓶进行定容 |
9.有关胶体等分散系的制备、性质的相关说法不正确的是( )
| A. | 向沸水中逐滴加入FeCl3饱和溶液,继续煮沸至液体呈红褐色,即制得Fe(OH)3胶体 | |
| B. | 向Fe(OH)3胶体中加入稀H2SO4至过量,现象为先生成红褐色沉淀,之后沉淀溶解 | |
| C. | 依据丁达尔效应可将分散系分为溶液、胶体与浊液 | |
| D. | 将Fe(OH)3胶体与硅酸溶胶相互混合,混合液变浑浊 |
13.Ⅰ.常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如表所示:
(1)从甲组情况分析,如何判断HA是强酸还是弱酸?a=7时,HA是强酸;a>7时,HA是弱酸.
(2)乙组混合溶液中c(A-)和c(Na+)的大小关系是C.
A.前者大 B.后者大
C.二者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是c(Na+)>c(A-)>c(OH-)>c(H+).
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):c(Na+)-c(A-)=10-4-10-10 mol/L.
Ⅱ.某二元酸(化学式用H2B表示)在水中的电离方程式是:H2B═H++HB-,HB-?H++B2-.
(5)在0.1mol/L的Na2B溶液中,下列粒子浓度关系式正确的是AC.
A.c(B2-)+c(HB-)=0.1mol/L
B.c(B2-)+c(HB-)+c(H2B)=0.1mol/L
C.c(OH-)=c(H+)+c(HB-)
D.c(Na+)+c(OH-)=c(H+)+c(HB-)
| 实验编号 | HA的物质的量浓度(mol/L) | NaOH的物质的量浓度(mol/L) | 混合后溶液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.12 | 0.1 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=10 |
(2)乙组混合溶液中c(A-)和c(Na+)的大小关系是C.
A.前者大 B.后者大
C.二者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是c(Na+)>c(A-)>c(OH-)>c(H+).
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):c(Na+)-c(A-)=10-4-10-10 mol/L.
Ⅱ.某二元酸(化学式用H2B表示)在水中的电离方程式是:H2B═H++HB-,HB-?H++B2-.
(5)在0.1mol/L的Na2B溶液中,下列粒子浓度关系式正确的是AC.
A.c(B2-)+c(HB-)=0.1mol/L
B.c(B2-)+c(HB-)+c(H2B)=0.1mol/L
C.c(OH-)=c(H+)+c(HB-)
D.c(Na+)+c(OH-)=c(H+)+c(HB-)
14.分析如图的能量变化示意图,确定下列热化学方程式书写正确的是( )
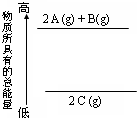

| A. | 2A+B=2C△H<0 | B. | 2C(g)=2A(g)+B(g)△H<0 | ||
| C. | 2 A(g)+B(g)=2C(g);△H>0 | D. | 2A(g)+B(g)=2C(g);△H<0 |