题目内容
18.已知:Na2SO3在空气中会被氧气氧化成Na2SO4.现将物质的量均为1mol的下述物质,长期放置于空气中(最终物质不考虑潮解情况),最后质量增加的大小关系是( )①Na2O
②Na2O2
③NaOH
④Na2SO3.
| A. | ①=③>②>④ | B. | ①>②>④>③ | C. | ③>①=②>④ | D. | ④>③>②>① |
分析 ①氧化钠和水反应生成氢氧化钠,二氧化碳和氢氧化钠反应生成碳酸钠;
②过氧化钠和水反应生成氢氧化钠,与二氧化碳反应生成碳酸钠;
③氢氧化钠与二氧化碳反应生成碳酸钠;
④亚硫酸钠和氧气反应生成硫酸钠.
解答 解:①氧化钠和水反应生成氢氧化钠,二氧化碳和氢氧化钠反应生成碳酸钠;Na2O~Na2CO3;1molNa2O反应最后增加1molCO2的质量为 44g;
②过氧化钠和水反应生成氢氧化钠,与二氧化碳反应生成碳酸钠;Na2O2~Na2CO3,1molNa2O2反应最后增加1molCO的质量为28g;
③氢氧化钠与二氧化碳反应生成碳酸钠;NaOH~$\frac{1}{2}$Na2CO3,1molNaOH反应最后增重53-40=13g;
④亚硫酸钠和氧气反应生成硫酸钠;Na2SO3~Na2SO4,1molNa2SO3反应后增重16g;
故增重为①>②>④>③;
故选B.
点评 本题考查钠及其化合物性质的应用,明确变化过程中的质量变化计算是解答本题的关键,题目难度中等.

练习册系列答案
相关题目
9.有关胶体等分散系的制备、性质的相关说法不正确的是( )
| A. | 向沸水中逐滴加入FeCl3饱和溶液,继续煮沸至液体呈红褐色,即制得Fe(OH)3胶体 | |
| B. | 向Fe(OH)3胶体中加入稀H2SO4至过量,现象为先生成红褐色沉淀,之后沉淀溶解 | |
| C. | 依据丁达尔效应可将分散系分为溶液、胶体与浊液 | |
| D. | 将Fe(OH)3胶体与硅酸溶胶相互混合,混合液变浑浊 |
6.现有分子式均为C3H6O2的四种有机物A、B、C、D,且分子中均含甲基,把它们分别进行下列实验加以鉴别,实验记录如下:
(1)则A、B、C的结构简式分别为:ACH3CH2COOH,BCH3CH(OH)CHO,CHCOOCH2CH3,
(2)写出D在NaOH溶液中水解的化学方程式CH3COOCH3+NaOH$→_{△}^{水}$CH3COONa+CH3OH.
| NaOH溶液 | 银氨溶液 | 新制Cu(OH)2悬浊液 | 金属钠 | |
| A | 中和反应 | - | 溶解 | 产生氢气 |
| B | - | 有银镜 | 加热后有砖红色沉淀 | 产生氢气 |
| C | 水解反应 | 有银镜 | 加热后有砖红色沉淀 | - |
| D | 水解反应 | - | - | - |
(2)写出D在NaOH溶液中水解的化学方程式CH3COOCH3+NaOH$→_{△}^{水}$CH3COONa+CH3OH.
13.Ⅰ.常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如表所示:
(1)从甲组情况分析,如何判断HA是强酸还是弱酸?a=7时,HA是强酸;a>7时,HA是弱酸.
(2)乙组混合溶液中c(A-)和c(Na+)的大小关系是C.
A.前者大 B.后者大
C.二者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是c(Na+)>c(A-)>c(OH-)>c(H+).
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):c(Na+)-c(A-)=10-4-10-10 mol/L.
Ⅱ.某二元酸(化学式用H2B表示)在水中的电离方程式是:H2B═H++HB-,HB-?H++B2-.
(5)在0.1mol/L的Na2B溶液中,下列粒子浓度关系式正确的是AC.
A.c(B2-)+c(HB-)=0.1mol/L
B.c(B2-)+c(HB-)+c(H2B)=0.1mol/L
C.c(OH-)=c(H+)+c(HB-)
D.c(Na+)+c(OH-)=c(H+)+c(HB-)
| 实验编号 | HA的物质的量浓度(mol/L) | NaOH的物质的量浓度(mol/L) | 混合后溶液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.12 | 0.1 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=10 |
(2)乙组混合溶液中c(A-)和c(Na+)的大小关系是C.
A.前者大 B.后者大
C.二者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是c(Na+)>c(A-)>c(OH-)>c(H+).
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):c(Na+)-c(A-)=10-4-10-10 mol/L.
Ⅱ.某二元酸(化学式用H2B表示)在水中的电离方程式是:H2B═H++HB-,HB-?H++B2-.
(5)在0.1mol/L的Na2B溶液中,下列粒子浓度关系式正确的是AC.
A.c(B2-)+c(HB-)=0.1mol/L
B.c(B2-)+c(HB-)+c(H2B)=0.1mol/L
C.c(OH-)=c(H+)+c(HB-)
D.c(Na+)+c(OH-)=c(H+)+c(HB-)
10.有甲、乙、丙三种物质:
甲: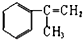 乙:
乙: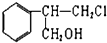
(1)关于乙下列叙述正确的是bd
a.1mol该有机物在加热和催化剂作用下,最多能和2mol NaOH反应
b.该有机物能使酸性KMnO4溶液褪色
c.该有机物的分子式为C9H11Cl
d.该有机物在一定条件下,能发生消去反应、取代反应、氧化反应和还原反应
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):
甲$→_{Ⅰ}^{一定条件}$ $→_{Ⅱ}^{一定条件}$Y$→_{Ⅲ}^{一定条件}$乙
$→_{Ⅱ}^{一定条件}$Y$→_{Ⅲ}^{一定条件}$乙
①反应Ⅰ的反应条件是光照
②其中反应II的化学方程式是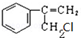 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$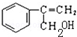 +NaCl
+NaCl
(3)由甲出发合成丙的路线之一如图:

①写出反应②的化学方程式
②写出C与丙的结构简式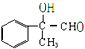 、
、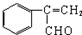 .
.
甲:
 乙:
乙: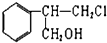
| 丙分子式 | C9H8O |
| 部分性质 | 能使Br2/CCl4褪色 |
a.1mol该有机物在加热和催化剂作用下,最多能和2mol NaOH反应
b.该有机物能使酸性KMnO4溶液褪色
c.该有机物的分子式为C9H11Cl
d.该有机物在一定条件下,能发生消去反应、取代反应、氧化反应和还原反应
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):
甲$→_{Ⅰ}^{一定条件}$
 $→_{Ⅱ}^{一定条件}$Y$→_{Ⅲ}^{一定条件}$乙
$→_{Ⅱ}^{一定条件}$Y$→_{Ⅲ}^{一定条件}$乙①反应Ⅰ的反应条件是光照
②其中反应II的化学方程式是
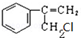 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$ +NaCl
+NaCl(3)由甲出发合成丙的路线之一如图:

①写出反应②的化学方程式

②写出C与丙的结构简式
 、
、 .
.
8. 向某无色溶液中滴加0.1mol/LBa(OH)2溶液至过量,加入的Ba(OH)2与生成的白色沉淀的物质的量如图所示,原无色溶液中含有的物质是( )
向某无色溶液中滴加0.1mol/LBa(OH)2溶液至过量,加入的Ba(OH)2与生成的白色沉淀的物质的量如图所示,原无色溶液中含有的物质是( )
 向某无色溶液中滴加0.1mol/LBa(OH)2溶液至过量,加入的Ba(OH)2与生成的白色沉淀的物质的量如图所示,原无色溶液中含有的物质是( )
向某无色溶液中滴加0.1mol/LBa(OH)2溶液至过量,加入的Ba(OH)2与生成的白色沉淀的物质的量如图所示,原无色溶液中含有的物质是( )| A. | 0.1molBa(HSO3)2 | B. | 0.05molBa(HSO3)2和0.1molNaHSO3 | ||
| C. | 0.2molNaHSO3 | D. | 0.075molBa(HSO3)2和0.05molNaHSO3 |
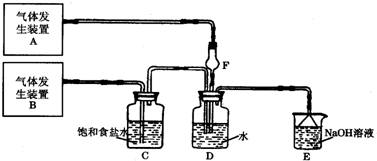
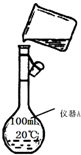 化学是一门以实验为基础的学科,化学所取得的丰硕成果,是与实验的重要作用分不开的.结合实验装置图回答问题:
化学是一门以实验为基础的学科,化学所取得的丰硕成果,是与实验的重要作用分不开的.结合实验装置图回答问题: