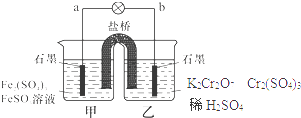
��Ŀ����
����Ŀ��ijѧ����0.100 0molL��1�������Һ�ⶨij�ռ���Ʒ�Ĵ��ȣ����ʲ������ᷴӦ����ʵ�鲽�����£�
��1�����ƴ���Һ����2.50g�����������ʵĹ����ռ���Ʒ����500mL��Һ�����õIJ������������ձ�����ͷ�ιܡ��������⣬����Ҫ ��
��2���ζ��� ��������ˮϴ����ʽ�ζ��ܣ�������ע���������Һ����0���̶������ϣ�
�̶��õζ��ܲ�ʹ�ζ��ܼ������Һ�壬����Һ������0����0���̶������£�����¼������
����ȡ20.00mL����Һע��ྻ����ƿ�У�������2�η�̪��Һ��
�����ñ�Һ�ζ����յ㣬��¼�ζ���Һ�������
�������ζ��������д�����ǣ����ţ� �� �ô�������ᵼ�²ⶨ���
���ƫ��ƫС������Ӱ�족����
�ڲ�����еζ�ʱ�۾�Ӧ �� �жϵζ��յ�������� ��
��������������Ӷ�����������и��Ӷ��������ʹ�ⶨ������ƫ��ƫС������Ӱ�족����
��3������ȷ��������й����ݼ�¼���£�
�ζ����� | ����Һ��� | �����������mL�� | |
�ζ�ǰ������mL�� | �ζ��������mL�� | ||
��һ�� | 20.00 | 0.20 | 20.38 |
�ڶ��� | 20.00 | 4.00 | 24.20 |
������ | 20.00 | 2.38 | a |
��a�Ķ�����ͼ��ʾ����a=��
���ռ���Ʒ�Ĵ���Ϊ%��
���𰸡�
��1��500mL����ƿ
��2����ƫ�۲���ƿ����Һ��ɫ�ı仯�����μ����һ�α�Һʱ������Һ�ɺ�ɫ�պñ�Ϊ��ɫ���Ұ�����ڲ���ɫ��ƫС
��3��22.60��80.8
���������⣺��1����2.50g�����������ʵĹ����ռ���Ʒ����500mL��Һ�����ƹ���Ϊ�����㡢�������ܽ⡢��ȴ��ת�ơ�ϴ�ӡ�ҡ�ȵȣ���Ҫ��������������ƽ���ձ�����������500mL����ƿ����ͷ�ιܣ����õIJ������������ձ�����ͷ�ιܡ��������⣬����Ҫ500mL����ƿ���ʴ�Ϊ��500mL����ƿ����2����������ˮϴ����ʽ�ζ��ܣ�Ȼ��������ʽ�ζ����ñ�Һ������ϴ������ᵼ�±�ҺŨ�ȼ�С�����ĵı�Һ���ƫ�ⶨ���ƫ�ʴ�Ϊ����ƫ�ڵζ�ʱ˫��Ӧע��۲���ƿ����Һ��ɫ�ı仯����ƿ�е����̪����ҺΪ��ɫ�����ŷ�Ӧ���У�����������������ǡ�÷�Ӧ����Һ����ɫ����ʧ�����Դﵽ�յ�����Ϊ�����μ����һ�α�Һʱ������Һ�ɺ�ɫ�պñ�Ϊ��ɫ���Ұ�����ڲ���ɫ���ʴ�Ϊ���۲���ƿ����Һ��ɫ�ı仯�����μ����һ�α�Һʱ������Һ�ɺ�ɫ�պñ�Ϊ��ɫ���Ұ�����ڲ���ɫ���۲���II�����Ӷ������ᵼ�µζ��ܵĶ���ƫ������и��Ӷ������ᵼ�µζ��ܶ���ƫС�����յ������ĵ��������ƫС���ⶨ���ƫ�ͣ��ʴ�Ϊ��ƫС����3���ٵζ�ʱ�ĵζ����е�Һ�棬�����Ϊ22.60mL���ʴ�Ϊ��22.60�� ������������������ֱ�Ϊ��20.38mL��0.20mL=20.18mL��24.20mL��4.00mL=20.20mL��22.6mL��2.38mL=20.22mL�����εζ����ݶ�����Ч�ģ��������������ƽ�����Ϊ�� ![]() =20.20mL��
=20.20mL��
���ݹ�ϵʽNaOH��HCl��֪��n��NaOH��=n��HCl��=0.1000molL��1��0.022mL=0.00202mol��
����20.00mL������Һ���У�m���ռ�TnM�T0.00202mol��40g/mol=0.808g��
����1000mL������Һ����m���ռ�T0.808g�� ![]() =2.02g��
=2.02g��
�ռ�Ĵ��Ȧأ��ռ= ![]() ��100%=80.8%��
��100%=80.8%��
�ʴ�Ϊ��80.8��
��1����������һ�����ʵ���Ũ�ȵ���Һ�����Ʋ���ѡ��ʹ�õ���������2����ʢ��Һ����ʽ�ζ��ܱ�����ϴ��������ȡ����ҺŨ��ƫ�ͣ��ڵζ�ʱ�۾�ע����ƿ����ɫ�仯�����ݴ���Һ�м����̪����ҺΪ��ɫ���кͷ�Ӧ��������Һ��ɫ��ʧ�����жϣ��۵ζ�ǰ���ӣ����¶���ƫ�ζ����ӻᵼ�¶���ƫС����3���ٸ��ݵζ��ܵĽṹ�;�ȷ�ȣ����ȷ������ݵ���Ч�ԣ����ݵζ��ܶ�������������Һ���������������������ƽ�������Ȼ����ݹ�ϵʽNaOH��HCl����������Ƶ����ʵ������ټ����ռ���Ʒ�Ĵ��ȣ�

 ������ÿ�ʱ��ҵϵ�д�
������ÿ�ʱ��ҵϵ�д�����Ŀ����֪��ѧ��Ӧ�٣� Fe��s��+CO2��g���TFeO��s��+CO��g������ƽ�ⳣ��ΪK1����ѧ��Ӧ�ڣ�
Fe��s��+H2O��g���TFeO��s��+H2��g������ƽ�ⳣ��ΪK2 �� ���¶�
973K��1173K����£�K1��K2��ֵ�ֱ����£�
�¶� | K1 | K2 |
973K | 1.47 | 2.38 |
1173K | 2.15 | 1.67 |
��1��ͨ�������е���ֵ�����ƶϣ���Ӧ����������ȡ����ȡ�����Ӧ��
��2�����з�Ӧ�ۣ�CO2��g��+H2��g��=CO��g��+H2O��g��������д���÷�Ӧ��ƽ�ⳣ��K3����ѧ����ʽ��K3= ��
��3�����ݷ�Ӧ����ڿ��Ƶ���K1��K2��K3֮��Ĺ�ϵʽ �� �ݴ˹�ϵʽ���ϱ����ݣ�Ҳ���ƶϳ���Ӧ����������ȡ����ȡ�����Ӧ��Ҫʹ��Ӧ����һ�������½�����ƽ��������Ӧ�����ƶ����ɲ�ȡ�Ĵ�ʩ������д��ţ��� A����С��Ӧ�����ݻ� B������Ӧ�����ݻ�
C�������¶� D�������¶�
E��ʹ�ú��ʵĴ��� F���跨����CO����
��4��ͼ�ס��ҷֱ��ʾ��Ӧ����t1ʱ�̴ﵽƽ�⡢��t2ʱ����ı�ij�������������仯������� ��ͼ����t2ʱ�̷����ı�������� ��
��ͼ����t2ʱ�̷����ı�������� ��