题目内容
【题目】某学习小组的同学查阅相关资料知氧化性:Cr2O72﹣>Fe3+ , 设计了盐桥式的原电池,见图.盐桥中装有琼脂与饱和K2SO4溶液.下列叙述中正确的是( ) 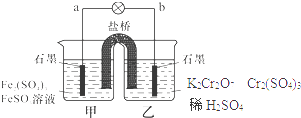
A.甲烧杯的溶液中发生还原反应
B.乙烧杯中发生的电极反应为:2Cr3++7H2O﹣6e﹣=Cr2O72﹣+14H+
C.外电路的电流方向是从b到a
D.电池工作时,盐桥中的SO42﹣ 移向乙烧杯
【答案】C
【解析】解:由于氧化性Cr2O72﹣>Fe3+ , 即Cr2O72﹣可以将Fe2+氧化为Fe3+ , 故在原电池中,Fe2+失电子被氧化,故a极为负极;Cr2O72﹣得电子被还原,故b极为正极.
A、Fe2+失电子被氧化,即甲池发生氧化反应,故A错误;
B、乙烧杯中Cr2O72﹣得电子被还原:Cr2O72﹣+6e﹣+14H+=2Cr3++7H2O,故B错误;
C、外电路中电流由正极流向负极,即由b流向a,故C正确;
D、原电池中,阴离子移向负极,即SO42﹣ 移向甲烧杯,故D错误.
故选C.

 一线名师提优试卷系列答案
一线名师提优试卷系列答案【题目】某学生用0.100 0molL﹣1盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应).实验步骤如下:
(1)配制待测液:用2.50g含有少量杂质的固体烧碱样品配制500mL溶液.需用的玻璃仪器除了烧杯、胶头滴管、玻璃棒外,还需要 .
(2)滴定: Ⅰ.用蒸馏水洗涤酸式滴定管,并立即注入盐酸标准溶液至“0”刻度线以上.
Ⅱ.固定好滴定管并使滴定管尖嘴充满液体,调节液面至“0”或“0”刻度线以下,并记录读数.
Ⅲ.移取20.00mL待测液注入洁净的锥形瓶中,并加入2滴酚酞试液.
Ⅳ.用标准液滴定至终点,记录滴定管液面读数.
①上述滴定步骤中有错误的是(填编号) , 该错误操作会导致测定结果
(填“偏大”“偏小”或“无影响”).
②步骤Ⅳ中滴定时眼睛应 , 判断滴定终点的现象是 .
③若步骤Ⅱ中仰视读数,步骤Ⅳ中俯视读数,则会使测定结果(填“偏大”“偏小”或“无影响”).
(3)按正确操作测得有关数据记录如下:
滴定次数 | 待测液体积 | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 20.00 | 0.20 | 20.38 |
第二次 | 20.00 | 4.00 | 24.20 |
第三次 | 20.00 | 2.38 | a |
①a的读数如图所示,则a=;
②烧碱样品的纯度为%.

