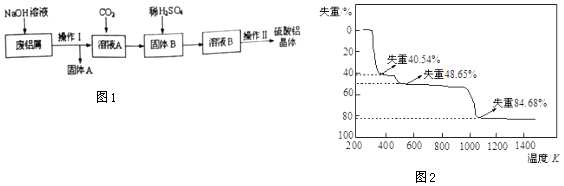
题目内容
【题目】已知:A、B、C、D四种短周期元素,A与D的原子序数之和等于B与C的原子序数之和,由D元素组成的单质在通常状况下呈黄绿色,B、C、D三种元素位于同一周期,A、B、C三种元素的最高价氧化物对应的水化物分别为X、Y、Z,且存在如下转化关系,试推断回答下列问题. 
(1)D元素原子的结构示意图为;
(2)A、B、C三种元素的原子半径由小到大的顺序为(用元素符号表示);
(3)Y与C元素的最高价氧化物可以发生反应,该反应的离子方程式为;
(4)A与D两元素的气态氢化物之间可以反应生成一种盐,该盐的水溶液呈(填“酸”、“碱”或“中”)性,该水溶液中各离子浓度由小到大的顺序为(用具体离子符号表示);
(5)实验室中,应将X的浓溶液保存在棕色试剂瓶中,其原因是(用化学方程式表示).
【答案】
(1)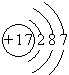
(2)N<Al<Na
(3)Al2O3+2OH﹣+3H2O=2[Al(OH)4]﹣
(4)酸;c(OH﹣)<c(H+)<c(NH4+)<c(Cl﹣)
(5)4HNO3(浓) ![]() 4NO2↑+O2↑+2H2O
4NO2↑+O2↑+2H2O
【解析】解:A、B、C、D四种短周期元素,A与D的原子序数之和等于B与C的原子序数之和,由D元素组成的单质在通常状况下呈黄绿色,所以D是Cl元素;B、C、D三种元素位于同一周期,在反应中B、C最高价氧化物的水化物生成盐和水,所以B、C应该是第三周期的金属元素,也就是说B、C应该是钠镁铝之间的,又因为Y+Z=盐和水,X+Z=盐+水,所以Z是氢氧化铝,C是铝;氢氧化铝可以和强碱生成偏铝酸盐和水,所以B应该是钠,C是铝,A与D的原子序数之和等于B与C的原子序数之和,得出A是氮.(1)D元素是氯元素,其原子结构示意图为 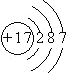 ,所以答案是:
,所以答案是: 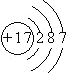 ;(2)电子层数越多,原子的半径越大,电子层数相同的原子,原子半径随着原子序数的增大而减小,所以原子半径由小到大的顺序为N<Al<Na,所以答案是:N<Al<Na;(3)Y是强碱,C的氧化物是氧化铝,氧化铝和强碱反应生成偏铝酸盐,离子方程式为:Al2O3+2OH﹣+3H2O=2[Al(OH)4]﹣ , 所以答案是:Al2O3+2OH﹣+3H2O=2[Al(OH)4]﹣;(4)A与D两元素的气态氢化物之间可以反应生成一种盐,该盐是氯化铵,氯化铵是强酸弱碱盐,能水解导致氢离子浓度大于氢氧根离子浓度,溶液呈酸性;铵根离子水解导致氯离子浓度大于铵根离子浓度,氢离子浓度大于氢氧根离子浓度,含有弱根离子的盐以电离为主水解为次,所以铵根离子浓度大于氢离子浓度, 所以答案是:酸;c(OH﹣)<c(H+)<c(NH4+)<c(Cl﹣);(5)X的浓溶液是浓硝酸,光照条件下,浓硝酸分解生成二氧化氮、氧气和水 4HNO3(浓)
;(2)电子层数越多,原子的半径越大,电子层数相同的原子,原子半径随着原子序数的增大而减小,所以原子半径由小到大的顺序为N<Al<Na,所以答案是:N<Al<Na;(3)Y是强碱,C的氧化物是氧化铝,氧化铝和强碱反应生成偏铝酸盐,离子方程式为:Al2O3+2OH﹣+3H2O=2[Al(OH)4]﹣ , 所以答案是:Al2O3+2OH﹣+3H2O=2[Al(OH)4]﹣;(4)A与D两元素的气态氢化物之间可以反应生成一种盐,该盐是氯化铵,氯化铵是强酸弱碱盐,能水解导致氢离子浓度大于氢氧根离子浓度,溶液呈酸性;铵根离子水解导致氯离子浓度大于铵根离子浓度,氢离子浓度大于氢氧根离子浓度,含有弱根离子的盐以电离为主水解为次,所以铵根离子浓度大于氢离子浓度, 所以答案是:酸;c(OH﹣)<c(H+)<c(NH4+)<c(Cl﹣);(5)X的浓溶液是浓硝酸,光照条件下,浓硝酸分解生成二氧化氮、氧气和水 4HNO3(浓) ![]() 4NO2↑+O2↑+2H2O,所以要避光保存,
4NO2↑+O2↑+2H2O,所以要避光保存,
所以答案是:4HNO3(浓) ![]() 4NO2↑+O2↑+2H2O.
4NO2↑+O2↑+2H2O.

【题目】某学生用0.100 0molL﹣1盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应).实验步骤如下:
(1)配制待测液:用2.50g含有少量杂质的固体烧碱样品配制500mL溶液.需用的玻璃仪器除了烧杯、胶头滴管、玻璃棒外,还需要 .
(2)滴定: Ⅰ.用蒸馏水洗涤酸式滴定管,并立即注入盐酸标准溶液至“0”刻度线以上.
Ⅱ.固定好滴定管并使滴定管尖嘴充满液体,调节液面至“0”或“0”刻度线以下,并记录读数.
Ⅲ.移取20.00mL待测液注入洁净的锥形瓶中,并加入2滴酚酞试液.
Ⅳ.用标准液滴定至终点,记录滴定管液面读数.
①上述滴定步骤中有错误的是(填编号) , 该错误操作会导致测定结果
(填“偏大”“偏小”或“无影响”).
②步骤Ⅳ中滴定时眼睛应 , 判断滴定终点的现象是 .
③若步骤Ⅱ中仰视读数,步骤Ⅳ中俯视读数,则会使测定结果(填“偏大”“偏小”或“无影响”).
(3)按正确操作测得有关数据记录如下:
滴定次数 | 待测液体积 | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 20.00 | 0.20 | 20.38 |
第二次 | 20.00 | 4.00 | 24.20 |
第三次 | 20.00 | 2.38 | a |
①a的读数如图所示,则a=;
②烧碱样品的纯度为%.
【题目】某同学用中和滴定法测定某烧碱的纯度,实验过程如下:
(1)a.配制待测液:称取4.1g固体烧碱样品(杂质不与酸反应)配制成250mL溶液. b.滴定
①用量取10.00mL待测液.
②向锥形瓶中加入几滴酚酞,用0.201 0molL﹣1的标准盐酸滴定待测烧碱溶液,边滴边摇动锥形瓶,眼睛注视锥形瓶内溶液颜色的变化,直到时停止滴定.
(2)数据处理
实验次 | 盐酸溶液体积 | 氢氧化钠溶液体积 |
1 | 19.90 | 10.00 |
2 | 20.10 | 10.00 |
3 | 22.00 | 10.00 |
4 | 20.00 | 10.00 |
根据上述表格,选取合适的数据,计算待测烧碱溶液的浓度为 , 烧碱的纯度为(保留两位小数).
(3)一定物质的量浓度溶液的配制和酸碱中和滴定是中学化学中两个典型的定量实验.某研究性学习小组在实验室中配制盐酸标准溶液,然后用其滴定某未知浓度的NaOH溶液.下列有关说法中正确的是(多选)
A.实验中所用到的滴定管、容量瓶,在使用前均需要检漏
B.如果实验中需用80mL的稀盐酸标准溶液,配制时应选用100mL容量瓶
C.容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小
D.酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀盐酸,则测得的NaOH溶液的浓度将偏大
E.配制溶液时,定容时俯视读数,则导致实验结果偏大
F.中和滴定时,若在最后一次读数时俯视读数,则导致实验结果偏大
G.锥形瓶用蒸馏水洗浄后,有少量蒸馏水残留,则导致实验结果偏小
H.滴定前滴定管尖嘴有气泡,滴定后气泡消失,则导致实验结果偏大.