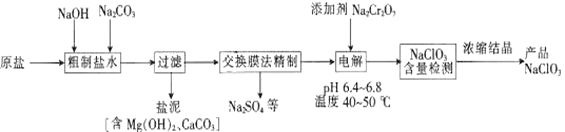
题目内容
【题目】碱式硫酸铝[(1x)Al2(SO4)3·xAl(OH)3]溶液可用于烟气脱硫。实验室用粉煤灰(主要含Al2O3、SiO2等)制备碱式硫酸铝溶液,实验流程如下:

已知“调pH”的反应为:(2x)Al2(SO4)3+3xCaCO3+3xH2O=2[(1x)Al2(SO4)3·xAl(OH)3]+3xCaSO4↓+3xCO2↑
(1)“酸浸”时反应的化学方程式为____。
(2)“酸浸”时适当增大H2SO4溶液浓度的目的是____,能达到相同目的的方法还有____(任写一种)。
(3)“酸浸”时应控制H2SO4溶液的用量,H2SO4溶液用量不能过量太多的原因是____。
(4)通过测定碱式硫酸铝溶液中相关离子的浓度确定x的值,测定方法如下:
①取碱式硫酸铝溶液25.00 mL,加入盐酸酸化的过量BaCl2溶液充分反应,静置后过滤、洗涤,干燥至恒重,得固体2.3300 g。
②取碱式硫酸铝溶液2.50 mL,加入0.1000 mol·L1 EDTA标准溶液25.00 mL,调节溶液pH约为4.2,煮沸,冷却后用0.08000 mol·L1 CuSO4标准溶液滴定过量的EDTA至终点,消耗CuSO4标准溶液20.00 mL(已知Al3+、Cu2+与EDTA反应的化学计量比均为1∶1)。
计算(1x)Al2(SO4)3·xAl(OH)3中的x值(写出计算过程)____。
【答案】Al2O3+3H2SO4=Al2(SO4)3+3H2O 加快酸浸时的反应速率(或提高铝元素的浸出率) 加热(或搅拌) 会增加后续CaCO3的消耗量 0.41
【解析】
(1)“酸浸”时氧化铝与硫酸反应生成硫酸铝和水,反应的化学方程式为Al2O3+3H2SO4=Al2(SO4)3+3H2O;
(2)“酸浸”时适当增大H2SO4溶液浓度的目的是加快酸浸时的反应速率(或提高铝元素的浸出率),能达到相同目的的方法还有加热(或搅拌);
(3)“酸浸”时应控制H2SO4溶液的用量,H2SO4溶液用量不能过量太多,若过量太多,会增加后续CaCO3的消耗量;
(4)2.50 mL溶液中:n(SO42-)=n(BaSO4)=![]() ,
,
2.50 mL溶液中:n(Al3+)=n(EDTA)-n(Cu2+)=0.1000mol/L×25.00mL×10-3L/mL-0.08000mol/L×20.00mL×10-3L/mL=9.000×10-3mol,
2.50 mL溶液中:n(Al3+)= 9.000×10-3mol,
1mol(1x)Al2(SO4)3·xAl(OH)3中n(Al3+)=(2-x)mol;n(SO42-)=3(1-x)mol;
n(Al3+):n(SO42-)=(2-x)mol:3(1-x)mol=9.000×10-3mol:00100mol,解得x=0.41。

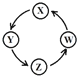
【题目】下列各组物质中,满足表中图示物质在一定条件下一步转化关系的组合有( )
序号 | X | Y | Z | W |
|
① | Si | Na2SiO3 | H2SiO3 | SiO2 | |
② | Na | NaOH | Na2CO3 | NaCl | |
③ | Cl2 | Ca(ClO)2 | HClO | HCl | |
④ | Fe | FeCl3 | FeCl2 | Fe(OH)2 |
A.②③B.①③④C.①④D.①②③