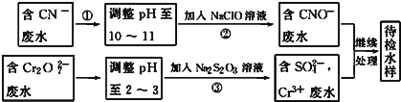
题目内容
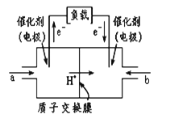
【题目】如图是甲醇燃料电池结构示意图,甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路质子经内电路到达另一极与氧气反应,电池总反应为2CH3OH+3O2→2CO2+4H2O。下列说法正确的是( )
A.该电池提供1mole-,消耗氧气0.5mol
B.正极反应式为O2+2H2O+4e-=40H-
C.负极反应式为CH3OH+H2O+6e-=CO2↑+6H+
D.左电极为电池的负极,a处通入的物质是甲醇
【答案】D
【解析】
A. 已知正极反应式为:O2+4H++4e-=2H2O,则消耗1mol氧气转移4mol电子,所以该电池提供1mole-,消耗氧气0.25mol,故A错误;
B. 酸性条件下,正极反应式为:O2+4H++4e-=2H2O,故B错误;
C. 负极上投放燃料甲醇,甲醇在负极上失电子生成二氧化碳,负极反应式为:CH3OH+H2O-6e-=CO2+6H+,故C错误;
D. 左电极是电池的负极,负极上投放燃料甲醇,甲醇在负极上失电子发生氧化反应,故D正确;
答案选D。

练习册系列答案
相关题目