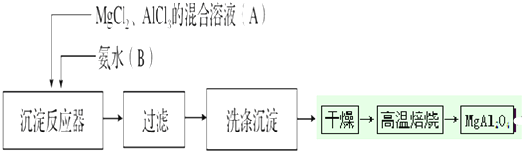
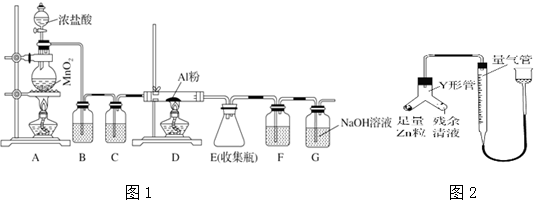
题目内容
11.A、B、C、D、E都是元素周期表中前20号元素,其原子序数依次增大.B、C、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族.B、C、D的最高价氧化物的水化物均能互相反应生成盐和水.A和E可形成离子化合物,其晶胞结构如图所示: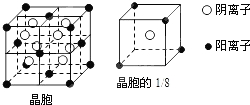
(1)A、C、D、E四种元素依次是F、Al、Cl、Ca (用元素符号表示)
(2)上述四种元素ABCD中第一电离能最小的是Na电负性最大的是F其原子半径由小到大的顺序为F<Cl<Al<Na(均用元素符号表示)
(3)A和D的氢化物中,前者沸点较高,原因是因为HF分子间存在氢键
(4)A和E的化合物晶体中,每个阳离子的周围与它最近且等距离的阳离子共有个12.
分析 B、C、D的最高价氧化物的水化物均能互相反应生成盐和水,说明含有两性氢氧化物,根据B、C、D同周期可判断B为Na元素,C为Al元素,E和其它元素既不在同周期也不在同主族且原子序数最大,应为第四周期元素,前20号元素中只有Ca符合,故E为Ca.根据$\frac{1}{8}$晶胞可知:含有Ca的个数为4×$\frac{1}{8}$=$\frac{1}{2}$,含有A的个数为1,故A和E可形成离子化合物的化学式为EA2,则A的化合价为-1价,应为H、F、Cl等元素中的一种,根据A、D同主族可知A为F,D为Cl元素,再结合物质结构、性质解答.
解答 解:B、C、D的最高价氧化物的水化物均能互相反应生成盐和水,说明含有两性氢氧化物,根据B、C、D同周期可判断B为Na元素,C为Al元素,E和其它元素既不在同周期也不在同主族且原子序数最大,应为第四周期元素,前20号元素中只有Ca符合,故E为Ca.根据$\frac{1}{8}$晶胞可知:含有Ca的个数为4×$\frac{1}{8}$=$\frac{1}{2}$,含有A的个数为1,故A和E可形成离子化合物的化学式为EA2,则A的化合价为-1价,应为H、F、Cl等元素中的一种,根据A、D同主族可知A为F,D为Cl元素,
(1)通过以上分析知,A、C、D、E依次是F、Al、Cl、Ca,
故答案为:F、Al、Cl、Ca;
(2)同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,同一主族中,元素的第一电离能随着原子序数的增大而减小,所以A、B、C、D四种元素的第一电离能最小的是Na元素,元素的非金属性越强其电负性越强,所以电负性最大的是F元素,原子的电子层数越多其原子半径越大,同一周期元素中,原子半径随着原子序数的增大而减小,所以其原子半径大小顺序是F<Cl<Al<Na,
故答案为:Na; F;F<Cl<Al<Na;
(3)A、D的氢化物分别是HF、HCl,因为HF中存在氢键导致HF的沸点较高,
故答案为:因为HF分子间存在氢键;
(4)A为F,E为Ca,在氟化钙晶体中,以晶胞顶点钙离子为例,与它最近且等距离的钙离子分布在经过该顶点的12个面的面心上,所以共有12个,
故答案为:12.
点评 本题考查了元素位置结构性质的相互关系及应用,涉及元素推断、晶体的计算、元素周期律等知识点,根据原子结构、物质性质确定元素,再结合均摊法、元素周期律等知识点来分析解答,题目难度不大.

| A. | 一CH3(甲基)的电子式为 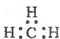 | B. | 硝基苯的结构简式: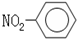 | ||
| C. | 甲醛的结构式: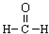 | D. | 乙醇的分子式:CH3CH2OH |
①微粒半径:S2->Cl>S
②氢化物的稳定性:HF>HCl>H2S
③还原性:S2->Cl->Br-
④氧化性:Cl2>S>Se
⑤酸性:H2SO4>HClO4>H2SeO4
⑥得电子能力:F>Cl>S.
| A. | ①⑤ | B. | ①③④ | C. | ②④⑥ | D. | ⑥ |
| A. | 化学反应速率是指一定时间内任何一种反应物浓度的减小或任何一种生成物浓度的增加 | |
| B. | 化学反应速率为0.8 mol/(L•s)是指1s时某物质的浓度为0.8mol/L | |
| C. | 根据化学反应速率的大小可以知道化学反应的相对快慢 | |
| D. | 对于任何化学反应来说,反应速率越大,反应现象越明显 |
| A. | 灼热的炭与二氧化碳反应 | |
| B. | 铁和稀硫酸的反应 | |
| C. | 氢氧化钡晶体的粉末和氯化铵晶体混合 | |
| D. | 生石灰溶于水 |
 利用核磁共振技术测定有机物分子的三维结构的研究获得了2002年诺贝尔化学奖.
利用核磁共振技术测定有机物分子的三维结构的研究获得了2002年诺贝尔化学奖.