题目内容
5.下列说法中,不符合ⅦA元素性质特征的是( )| A. | ⅦA族元素形成的单质的熔点随元素原子序数增大而升高 | |
| B. | ⅦA族元素易形成-1价离子 | |
| C. | 最高价氧化物的水化物显酸性 | |
| D. | 从上到下气态氢化物的稳定性依次增强 |
分析 ⅦA族元素原子核外最外层电子数为7,同主族元素从上到下,原子半径逐渐增大,元素的金属性逐渐增强,非金属性逐渐减弱,单质的熔点随元素原子序数增大而升高,以此解答.
解答 解:A.F、Cl、Br、I单质的熔点随元素原子序数增大而升高,故A不选;
B.ⅦA族元素原子核外最外层电子数为7,在反应中易得到1个电子形成-1价离子,故B不选;
C.Cl、Br、I的最高价氧化物的水化物均为强酸,显酸性,故C不选;
D.同主族元素从上到下,非金属性逐渐减弱,元素的非金属性越弱,对应的氢化物越不稳定,故D选.
故选D.
点评 本题考查同主族元素的性质的递变规律,侧重于基本概念的理解和运用的考查,注意把握元素周期律的递变规律,难度不大.

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目
10.据某媒体报道:德国科学家日前利用卫星数据和一种先进的仪器,绘制了一幅地球上空二氧化氮的分布图,从科学家绘制的二氧化氮分布图看,欧洲和北美洲的一些大城市上空二氧化氮密度很高,其原因是这些地区( )
| A. | 硝酸工业发达 | B. | 雷雨天气多 | C. | 机动车辆过多 | D. | 燃料以煤为主 |
17.下列实验或生产过程中发生的变化是物理变化的是( )
①在鸡蛋白溶液中加入(NH4)2SO4后形成沉淀;②用渗析的方法除去混在Fe(OH)3胶体中的FeCl3;③NO2经加压凝聚成无色的液体;④溴水滴入植物油中振荡褪色;⑤水泥、沙子和水混合后硬化;⑥照相底片感光.
①在鸡蛋白溶液中加入(NH4)2SO4后形成沉淀;②用渗析的方法除去混在Fe(OH)3胶体中的FeCl3;③NO2经加压凝聚成无色的液体;④溴水滴入植物油中振荡褪色;⑤水泥、沙子和水混合后硬化;⑥照相底片感光.
| A. | ①②③ | B. | ②④⑥ | C. | ①② | D. | ③⑤ |
15.已知形成1molH-H键需放出436kJ的能量;断开1molN-H键需吸收391kJ的能量.1molN2和3molH2完全反应生成2molNH3时放出92.4kJ的能量.则要断开1molN≡N键,所需要( )
| A. | 431kJ | B. | 946 kJ | C. | 649kJ | D. | 869 kJ |
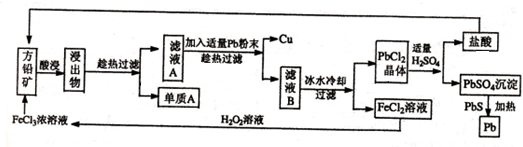
 HCO3-+OH-,溶液显碱性,促进油脂的水解(结合相关离子方程式解释).
HCO3-+OH-,溶液显碱性,促进油脂的水解(结合相关离子方程式解释).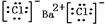 ,⑤的形成过程用电子式表示为
,⑤的形成过程用电子式表示为 .
.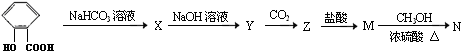
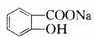 Y
Y M
M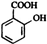 N
N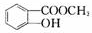
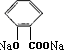 +CO2+H2O→
+CO2+H2O→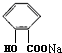 +NaHCO3.
+NaHCO3.