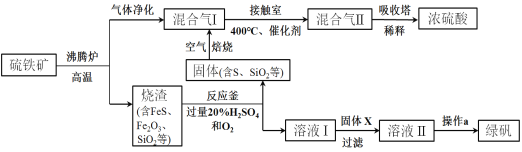
��Ŀ����
����Ŀ��ʵ������Ҫ0.1mol/LNaOH��Һ450mL�� 0.5mol/L������Һ450mL.������������Һ����������ش��������⣺
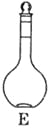
��1����ͼ��ʾ��������������Һ�϶�����Ҫ����____________��������ţ�����C��������________,��ʵ�����貣������E����������___________��
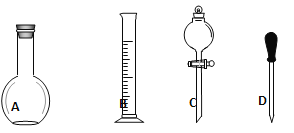
��2�����в����У�����ƿ�����߱��Ĺ�����__________������ţ�
A������һ�����ȷŨ�ȵı���Һ | B������������Һ |
C�����������ܽ�������� | D����ȡ220���������Һ |
��3��������NaOH��Һʵ���У�������������ȷ��������ʱ���ӿ̶��ߣ�������������ҺŨ��_____________0.1mol/L������������������������С��������ͬ������NaOH��Һδ��ȴ��ת��������ƿ���ݣ�����������ҺŨ��__________0.1mol/L��
��4�����ݼ����֪��������������Ϊ98%���ܶ�Ϊ1.84g.cm-3��Ũ��������Ϊ__________mL������������һλС���������ʵ������l0mL��25mL��50mL��Ͳ����Ӧѡ��__________mL������Ͳ��á�
��5���������ʱ��С�ij����̶��ߣ�Ӧ��β���___________��
���𰸡���1��AC����Һ©���� 500mL����ƿ����2��BCD��
��3��С�ڣ����ڣ���4��13.6�� 25����5���������ơ�
�������������������1������һ�����ʵ���Ũ����Һ��һ�㲽�裺���㡢�������ܽ⡢��ȴ����Һ��ϴ�ӡ����ݡ�ҡ�ȣ��õ���������������ƽ��ҩ�ס��ձ���������������ƿ����ͷ�ιܣ��ò�����������ƽ����ƿ�ͷ�Һ©��������C������Ϊ��Һ©������Ҫ0.1mol/L NaOH��Һ450mL��0.5mol/L������Һ450mL��ʵ����û��450mL����ƿ������Ӧѡ��500mL����ƿ���ʴ�Ϊ��AC����Һ©����500mL����ƿ��
��2������ƿֻ����������һ�����ȷŨ�ȵ���Һ���������ƻ��������ƿ������µ����������Һ�壬����ϡ�ͻ��ܽ�ҩƷ���������������ܽ�������ʣ���ѡ��BCD��
��3��������ʱ���ӿ̶��ߣ�������Һ���ƫ����ҺŨ��ƫС����NaOH��Һδ��ȴ��ת��������ƿ���ݣ���ȴ����Һ���ƫС����ҺŨ��ƫ�ʴ�Ϊ��С�ڣ����ڣ�
��4����������Ϊ98%���ܶ�Ϊ1.84g/cm3��Ũ�������ʵ���Ũ��C=![]() =18.4mol/L����0.5mol/L������Һ500mL��ҪŨ�������ΪV����������Һϡ������Һ�������ʵ����ʵ������ֲ���ã�V��18.4mol/L=0.5mol/L��500mL�����V=13.6mL����ѡ��25mL��Ͳ���ʴ�Ϊ��13.6��25.0��
=18.4mol/L����0.5mol/L������Һ500mL��ҪŨ�������ΪV����������Һϡ������Һ�������ʵ����ʵ������ֲ���ã�V��18.4mol/L=0.5mol/L��500mL�����V=13.6mL����ѡ��25mL��Ͳ���ʴ�Ϊ��13.6��25.0��
��5���������ʱ��С�ij����̶��ߣ�ʵ��ʧ�ܣ��Ҳ��ܲ��ȣ������������ƣ��ʴ�Ϊ���������ơ�