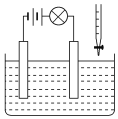
题目内容
【题目】已知:①2CO(g)+O2(g)=2CO2(g) ΔH=-568kJ·mol-1
②H2(g)+1/2O2(g)=H2O(g) ΔH=-248kJ·mol-1
已知 CO 和 H2 的混合物 1 mol 在氧气中充分燃烧放出的热量 272 kJ,则该混合气体中 CO 和氢气的物质的量的比值为
A.1∶1 B.3∶37 C.2∶1 D.3∶2
【答案】C
【解析】
试题分析:设CO的物质的量为x,H2的物质的量为y。由CO和H2的混合物为1mol,可得:x+y=1……①,由CO和H2在氧气中充分燃烧放出的热量272kJ,可得:x×![]() +y×248=272……②,解①②得:x=
+y×248=272……②,解①②得:x=![]() 、y=
、y=![]() ,故该混合气体中CO和氢气的物质的量的比值为2:1,答案选C。
,故该混合气体中CO和氢气的物质的量的比值为2:1,答案选C。

【题目】实验室需要0.1mol/LNaOH溶液450mL和 0.5mol/L硫酸溶液450mL.根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是____________。(填序号)仪器C的名称是________,苯实验所需玻璃仪器E规格和名称是___________。
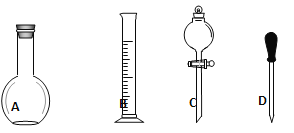
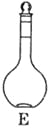
(2)下列操作中,容量瓶所不具备的功能有__________(填序号)
A.配制一定体积准确浓度的标准溶液 | B.长期贮存溶液 |
C.用来加热溶解固体溶质 | D.量取220毫升体积的液 |
(3)在配制NaOH溶液实验中,共它操作均正确,若定容时仰视刻度线,则所配制溶溶液浓度_____________0.1mol/L(填“大于”“等于”或“小于”,下同)。若NaOH溶液未冷却即转移至容量瓶定容,则所配制溶液浓度__________0.1mol/L。
(4)根据计算得知:所需质量分数为98%、密度为1.84g.cm-3的浓硫酸的体积为__________mL(计算结果保留一位小数)。如果实验室有l0mL、25mL、50mL量筒,,应选用__________mL规格的量筒最好。
(5)如果定容时不小心超过刻度线,应如何操作___________。