题目内容
【题目】利用硫铁矿(主要成分FeS2)生产硫酸和绿矾(FeSO4·7H2O)的工业流程示意图如下:
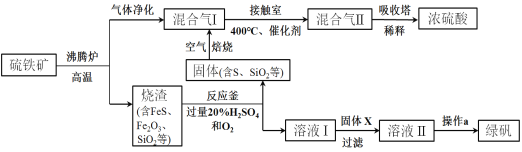
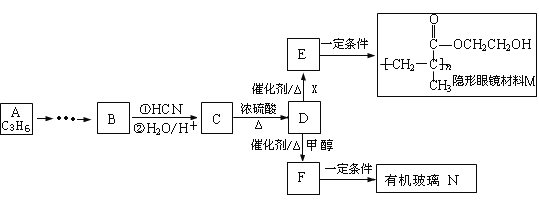
(1)沸腾炉中,硫铁矿进行粉碎处理的目的是 。
(2)接触室中,发生的主要反应是SO2与O2的反应,其化学方程式是 。
(3)反应釜中,烧渣经过反应转化为溶液I和固体。
① 烧渣中的FeS在反应中做 剂(填“氧化”或“还原”)。
② 溶液I中所含溶质的化学式是 。
(4)操作a的主要步骤是:加热浓缩、 、过滤洗涤。
(5)流程中,固体X可以选择硫铁矿(FeS2)或 ;当固体X为硫铁矿(FeS2)时,将溶液I与固体X发生反应的离子方程式补充完整:
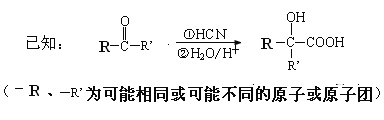
FeS2+![]() +
+![]() ===
===![]() Fe2++
Fe2++![]() SO42-+
SO42-+![]()
【答案】(1)增大反应物的接触面积,提高化学反应速率
(2)2SO2+O2![]() 2SO3
2SO3
(3)①还原(1分)②Fe2(SO4)3H2SO4(每个1分)(4)冷却结晶
(5)铁粉(或Fe)(1分)FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+
【解析】
试题分析:(1)沸腾炉中,硫铁矿进行粉碎处理的目的是增大反应物的接触面积,提高化学反应速率。
(2)接触室中,发生的主要反应是SO2与O2的反应,其化学方程式是2SO2+O2![]() 2SO3。
2SO3。
(3)①反应中S元素化合价从—2价升高到0价,失去单质,所以烧渣中的FeS在反应中做还原剂。②由于通入氧气,因此溶液I中所含溶质的化学式是Fe2(SO4)3,又因为硫酸过量,因此还有H2SO4。
(4)操作a的主要步骤是:加热浓缩、冷却结晶、过滤洗涤。
(5)由于最终要得到硫酸亚铁,所以需要铁粉把硫酸铁还原为硫酸亚铁;S元素化合价从—1价升高到+6价,失去7个电子,而铁元素化合价从+3价降低到+2价,得到1个电子,因此根据电子得失守恒可知反应的方程式为FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+。

 名校课堂系列答案
名校课堂系列答案【题目】实验室需要0.1mol/LNaOH溶液450mL和 0.5mol/L硫酸溶液450mL.根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是____________。(填序号)仪器C的名称是________,苯实验所需玻璃仪器E规格和名称是___________。
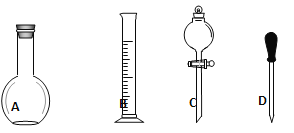
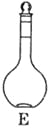
(2)下列操作中,容量瓶所不具备的功能有__________(填序号)
A.配制一定体积准确浓度的标准溶液 | B.长期贮存溶液 |
C.用来加热溶解固体溶质 | D.量取220毫升体积的液 |
(3)在配制NaOH溶液实验中,共它操作均正确,若定容时仰视刻度线,则所配制溶溶液浓度_____________0.1mol/L(填“大于”“等于”或“小于”,下同)。若NaOH溶液未冷却即转移至容量瓶定容,则所配制溶液浓度__________0.1mol/L。
(4)根据计算得知:所需质量分数为98%、密度为1.84g.cm-3的浓硫酸的体积为__________mL(计算结果保留一位小数)。如果实验室有l0mL、25mL、50mL量筒,,应选用__________mL规格的量筒最好。
(5)如果定容时不小心超过刻度线,应如何操作___________。
【题目】
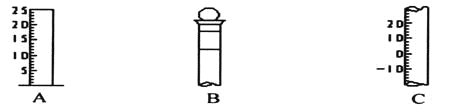
(1)请写出下列仪器的名称:A ,B ,C 。
(2)仪器B上标记有 (填序号)。
①质量 ②温度 ③刻度线 ④浓度 ⑤容积
Ⅱ.现用98%的浓H2SO4(密度为1.84g/cm3)来配制480mL0.2mol/L的稀H2SO4。
有关操作为:①计算所需浓硫酸的体积 ②量取一定体积的浓硫酸 ③稀释、冷却 ④转移、洗涤 ⑤定容 ⑥摇匀。回答下列问题
(3)应用量筒量取的浓硫酸体积是 mL,实验中所用的玻璃仪器除烧杯、玻璃棒、量筒、胶头滴管外还有 。
(4)第③步中稀释浓硫酸的操作是 。
(5)将所配制的稀H2SO4进行测定,发现实际浓度大于0.2mol/L。请你分析下列哪些操作会引起所配浓度偏大(填写字母) 。
A.用量筒量取浓硫酸时,仰视量筒的刻度 |
B.容量瓶未干燥即用来配制溶液 |
C.浓硫酸在烧杯中稀释后,未冷却就立即转移到容量瓶中,并进行定容 |
D.往容量瓶转移时,有少量液体溅出 |
E.烧杯未进行洗涤
F.在容量瓶中定容时俯视容量瓶刻度线
G.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线。