��Ŀ����
����Ŀ���⼰�仯����������������ͿƼ��ȷ��涼������Ҫ��Ӧ�á��ش��������⣺
��1���ⲻ������ˮ���������ڵ⻯����Һ�����ɶ�����ӣ���Ӧ���£�
��I2��s��+I-��aq��![]() I3-��aq����H<0����I2��s��+2I-��aq��
I3-��aq����H<0����I2��s��+2I-��aq��![]() I42-��aq��
I42-��aq��
��Ӧ����ƽ�ⳣ���ı���ʽΪK=____________���¶�����ʱ����Ӧ����ƽ�ⳣ����____________����������������С��������������
��2����������һ���¶��£��ɷ������¿��淴Ӧ��W��s��+I2��g��![]() WI2��g����ȷ��ȡ0.508g���0.736g�����ٷ�����50.0mL���ܱ������У�������ʹ�䷴Ӧ����ͼ�ǻ�������е�WI2���������ʵ�����ʱ��仯��ϵ��ͼ��[n��WI2����t]��������������0��t2ʱ������ķ�Ӧ�¶�Ϊ450��������������t2ʱ�̿�ʼ���ķ�Ӧ�¶�Ϊ530��
WI2��g����ȷ��ȡ0.508g���0.736g�����ٷ�����50.0mL���ܱ������У�������ʹ�䷴Ӧ����ͼ�ǻ�������е�WI2���������ʵ�����ʱ��仯��ϵ��ͼ��[n��WI2����t]��������������0��t2ʱ������ķ�Ӧ�¶�Ϊ450��������������t2ʱ�̿�ʼ���ķ�Ӧ�¶�Ϊ530��

���÷�Ӧ��H_________0������>������<������
����Ӧ�ӿ�ʼ��t1��t1=3min��ʱ���ڵ�ƽ������v��I2��= ____________
����450��ʱ���÷�Ӧ��ƽ�ⳣ��K=____________��
���ܹ�˵��������Ӧ�Ѿ��ﵽƽ��״̬����____________ ����ѡ����ĸ��
A.I2��WI2��Ũ�����
B.��λʱ���ڣ����������ĵ����ʵ����뵥�ʵ����ɵ����ʵ������
C.�����ڻ��������ܶȲ��ٸı�
D.����������ѹǿ�������仯
��3��I2O5�ǰ�ɫ��ĩ״���壬������������ʹH2S��CO��HC1���������ںϳɰ���ҵ�г���I2O5����������CO�ĺ�����
��֪����2I2��s��+5O2��g����2I2O5��s����H��-75.56kJmol-1
��2CO��g��+O2��g����2CO2��g����H��-566.0kJmol-1��
д��CO��g����I2O5��s����Ӧ������̬I2���Ȼ�ѧ����ʽ��_____________________��
���𰸡�
��1��c��I42-��/c2��I-��������
��2����<����0.012mol��L-1��min-1����9����BC��
��3��5CO��g��+I2O5��s��=5CO2��g��+I2��s����H=��1377.22kJ/mol
��������
�����������1����֪����ʽI2��s��+2I-��aq��I42-������ƽ�ⳣ������ʽΪ��K=![]() ����֪��Ӧ������H��0�����������¶�ƽ�����淽���ƶ�����ƽ�ⳣ����С���ʴ�Ϊ��
����֪��Ӧ������H��0�����������¶�ƽ�����淽���ƶ�����ƽ�ⳣ����С���ʴ�Ϊ��![]() ����С��
������
��2������1�������¶ȣ���ѧƽ�������ȷ����ƶ��������¶�ʱ��WI2�����ʵ������٣����Ը÷�Ӧ���淴Ӧ�����ƶ������淴Ӧ�����ȷ�Ӧ����������Ӧ�Ƿ��ȷ�Ӧ����H��0���ʴ�Ϊ������
����Ϊv��WI2��=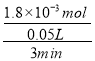 =1.20��10-2 molL-1min-1�����ڷ�Ӧ����֮�ȵ��ڼ�����֮�ȣ�����v��I2��=1.20��10-2molL-1min-1���ʴ�Ϊ��1.20��10-2molL-1min-1��
=1.20��10-2 molL-1min-1�����ڷ�Ӧ����֮�ȵ��ڼ�����֮�ȣ�����v��I2��=1.20��10-2molL-1min-1���ʴ�Ϊ��1.20��10-2molL-1min-1��
����Ӧ��ʼʱ��������ʵ���Ϊn=![]() =0.002mol����Ӧ��ƽ��ʱ����WI21.80��10-3mol�����ݻ�ѧ����ʽ��֪����Ҫ��1.80��10-3mol�μӷ�Ӧ��ʣ���0.0002mol������ƽ��ʱ��c��WI2��=
=0.002mol����Ӧ��ƽ��ʱ����WI21.80��10-3mol�����ݻ�ѧ����ʽ��֪����Ҫ��1.80��10-3mol�μӷ�Ӧ��ʣ���0.0002mol������ƽ��ʱ��c��WI2��=![]() =3.6��10-2mol/L��c��I2��=
=3.6��10-2mol/L��c��I2��=![]() =0.004mol/L����ΪW�ǹ��壬����K=
=0.004mol/L����ΪW�ǹ��壬����K=![]() =9���ʴ�Ϊ��9��
=9���ʴ�Ϊ��9��
����Ӧ�ﵽƽ��״̬ʱ�����淴Ӧ������ȣ�ƽ��ʱ�������ʵ����ʵ�����Ũ�ȵȲ��ٷ����仯��A����Ӧ��ƽ��ʱ��I2��WI2��Ũ�ȿ������Ҳ���ܲ��ȣ��뷴Ӧ��ʼŨ�ȼ�ת�����йأ����Բ���֤���ﵽƽ��״̬����A����B����λʱ���ڣ����������ĵ����ʵ����뵥�ʵ����ɵ����ʵ�����ȣ��÷�Ӧ�����淴Ӧ������ȣ����Դﵽƽ��״̬����B��ȷ��C��ƽ��ʱ�������ʵ����ʵ�����������Ҳ���䣬������������䣬�����ܶȲ��ٱ仯����C��ȷ��D���÷�Ӧ�Ƿ�Ӧǰ�������������ķ�Ӧ�����۷�Ӧ�Ƿ�ﵽƽ��״̬��ѹǿʼ�ղ��䣬��D���ʴ�Ϊ��BC��
��3����֪�Ȼ�ѧ����ʽ����2I2��s��+5O2��g��=2I2O5��s������H=-75.56kJmol-1����2CO��g��+O2��g��=2CO2��g������H=-566.0kJmol-1�����ݸ�˹���ɽ�����ʽ�ڡ�![]() -�١�
-�١�![]() ��5CO��g��+I2O5��s��=5CO2��g��+I2��s������H=��-566.0kJmol-1����
��5CO��g��+I2O5��s��=5CO2��g��+I2��s������H=��-566.0kJmol-1����![]() -��-75.56kJmol-1����
-��-75.56kJmol-1����![]() =-1377.22kJ/mol���������Ȼ�ѧ��Ӧ����ʽΪ��5CO��g��+I2O5��s��=5CO2��g��+I2��s����H=-1377.22kJ/mol���ʴ�Ϊ��5CO��g��+I2O5��s��=5CO2��g��+I2��s����H=-1377.22kJ/mol��
=-1377.22kJ/mol���������Ȼ�ѧ��Ӧ����ʽΪ��5CO��g��+I2O5��s��=5CO2��g��+I2��s����H=-1377.22kJ/mol���ʴ�Ϊ��5CO��g��+I2O5��s��=5CO2��g��+I2��s����H=-1377.22kJ/mol��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ��T��ʱ�������Ϊ0.5L�����������ܱ������з������淴Ӧ��2A(g)+B(g) ![]() 2C(g)��H=-QkJ/mol(Q>0)�������¶Ȳ��䣬ʵ������ʼ��ƽ��ʱ���й��������±���
2C(g)��H=-QkJ/mol(Q>0)�������¶Ȳ��䣬ʵ������ʼ��ƽ��ʱ���й��������±���
���� ��� | ��ʼʱ���������ʵ���/mol | ��ƽ��ʱ��ϵ�����ı仯 | ||
A | B | C | ||
�� | 2 | 1 | 0 | ���� 0.75QkJ |
�� | 0.4 | 0.2 | 1.6 | |
������������ȷ���ǣ� ��
A. �����������з�Ӧ��ƽ�ⳣ����Ϊ4
B. �������дﵽƽ��ʱ�ų�������Ϊ0.05QkJ
C. ����������ͨ�뺤����ƽ��ʱA��ת���ʲ���
D. �����������䣬�������ڱ��ֺ��ݾ��ȣ���ﵽƽ��ʱC���������С��2/3
����Ŀ��ʵ������Ҫ0.1mol/LNaOH��Һ450mL�� 0.5mol/L������Һ450mL.������������Һ����������ش��������⣺
��1����ͼ��ʾ��������������Һ�϶�����Ҫ����____________��������ţ�����C��������________,��ʵ�����貣������E����������___________��
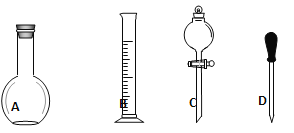
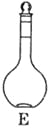
��2�����в����У�����ƿ�����߱��Ĺ�����__________������ţ�
A������һ�����ȷŨ�ȵı���Һ | B������������Һ |
C�����������ܽ�������� | D����ȡ220���������Һ |
��3��������NaOH��Һʵ���У�������������ȷ��������ʱ���ӿ̶��ߣ�������������ҺŨ��_____________0.1mol/L������������������������С��������ͬ������NaOH��Һδ��ȴ��ת��������ƿ���ݣ�����������ҺŨ��__________0.1mol/L��
��4�����ݼ����֪��������������Ϊ98%���ܶ�Ϊ1.84g.cm-3��Ũ��������Ϊ__________mL������������һλС���������ʵ������l0mL��25mL��50mL��Ͳ����Ӧѡ��__________mL������Ͳ��á�
��5���������ʱ��С�ij����̶��ߣ�Ӧ��β���___________��