题目内容
【题目】一定温度下,一定体积的容器中发生反应:A(s)+3B(g)![]() 2C(g)+2D(g),下列描述中能说明该反应达到平衡的是
2C(g)+2D(g),下列描述中能说明该反应达到平衡的是
①A的质量不发生变化 ②单位时间内生成a mol A,同时消耗2a mol C
③容器中的压强不再变化 ④混合气体的密度不再变化
⑤n(A):n(B):n(C):n(D)=1:3:2:2 ⑥B的浓度不变
A. ②③⑤⑥ B. ①③④⑥ C. ②④⑤ D. ②③④
【答案】B
【解析】
在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,所以①⑥正确;②中反应速率的方向是相同的,速率之比是相应的化学计量数之比,因此②中的关系始终是成立,不正确;反应前后气体体积是增大的,所以压强也是增大的,因此容器中的压强不再变化可以说明达到平衡状态,③正确;密度是混合气的质量和容器容积的比值,在反应过程中容积始终是不变的,但质量是变化的,所以④可以说明;平衡时浓度不再发生变化,但物质之间的浓度不一定相等或满足某种关系,所以⑤不正确,符合题意①③④⑥;正确选项B。

 小学教材完全解读系列答案
小学教材完全解读系列答案【题目】下列实验操作规范且能达到目的的是
目的 | 操作 | |
A. | 取20.00 mL盐酸 | 在50 mL酸式滴定管中装入盐酸,调整初始读数为30.00 mL后,将剩余盐酸放入锥形瓶 |
B. | 测定醋酸钠溶液pH | 用玻璃棒蘸取溶液,点在湿润的pH试纸上 |
C. | 清洗碘升华实验所用试管 | 先用酒精清洗,再用水清洗 |
D. | 配制浓度为0.010 | 称取KMnO4固体0.158 g,放入100 mL容量瓶中,加水溶解并稀释至刻度 |
A. A B. B C. C D. D
【题目】已知锌与稀盐酸反应放热,某学生为了探究反应过程中的速率变化,用排水集气法收集反应放出的氢气。所用稀盐酸浓度有1.00 mol·L-1、2.00 mol·L-1两种浓度,每次实验稀盐酸的用量为25.00 mL,锌有细颗粒与粗颗粒两种规格,用量为6.50 g。实验温度为298 K、308 K。
(1)完成以下实验设计(填写表格中空白项),并在实验目的一栏中填出对应的实验编号:
编号 | T/K | 锌规格 | 盐酸浓度/mol·L-1 | 实验目的 |
① | 298 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究盐酸浓度对该反应速率的影响; (Ⅱ)实验①和_______探究温度对该反应速率的影响; (Ⅲ)实验①和______探究锌规格(粗、细)对该反应速率的影响。 |
② | 298 | 粗颗粒 | 1.00 | |
③ | 308 | 粗颗粒 | 2.00 | |
④ | 298 | 细颗粒 | 2.00 |
(2)实验①记录如下(换算成标况):
时间(s) | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | span>100 |
氢气体积 (mL) | 16.8 | 39.2 | 67.2 | 224 | 420 | 492.8 | 520.8 | 543.2 | 554.4 | 560 |
①计算在30s~40s范围内盐酸的平均反应速率ν(HCl)=________(忽略溶液体积变化)。
②反应速率最大的时间段(如0s~10s......)为_______,可能原因是______。
③反应速率最小的时间段为________,可能原因是_________________________________。
(3)另一学生也做同样的实验,由于反应太快,测量氢气的体积时不好控制,他就事先在盐酸溶液中分别加入等体积的下列溶液以减慢反应速率,在不影响产生H2气体总量的情况下,你认为他上述做法中可行的是____________(填相应字母);
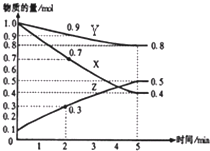
A.氨水 B.CuCl2溶液 C.NaCl溶液 D.KNO3溶液
(4)另有某温度时,在2L容器中X、Y、Z物质的量随时间的变化关系曲线如下图所示,该反应的化学方程式为:_____________________________。