题目内容
【题目】下列图示且与对应的叙述不相符的是( )

A.图1表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB溶液的pH
B.图2表示 KNO3 的溶解度曲线,a点所示的溶液是80℃时KNO3的不饱和溶液
C.图3 表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
D.图4表示恒温恒容条件下,2NO2(g)![]() N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
【答案】D
【解析】
A.pH相同的两种酸稀释相同的倍数,较强的酸pH变化大,由图1知酸性:HA>HB,组成盐的酸根对应的酸越弱,该盐的水解程度越大,则NaA溶液的pH小于同浓度的NaB溶液的pH,正确;
B.根据图2知80℃时,a点100g水中溶解的硝酸钾的质量小于硝酸钾的溶解度,故a点所示的溶液是80℃时KNO3的不饱和溶液,正确;
C.放热反应中反应物的总能量高于生成物的总能量,使用催化剂能降低反应的活化能,不能改变反应的始终态,不能改变反应热,与图3 相符,正确;
D.恒温恒容条件下,反应:2NO2(g)![]() N2O4(g)达到平衡时正、逆反应速率相等,即v(NO2)分解=2v(N2O4)分解,而图4中A点v(NO2)分解=v(N2O4)分解,反应未达到平衡状态,错误;
N2O4(g)达到平衡时正、逆反应速率相等,即v(NO2)分解=2v(N2O4)分解,而图4中A点v(NO2)分解=v(N2O4)分解,反应未达到平衡状态,错误;
故答案选D。

【题目】研究电解质在水溶液中的平衡能了解它的存在形式。
(1)已知部分弱酸的电离常数如下表:
化学式 | HF | H2CO3 | H2S |
电离平衡常数K (25℃) | 7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 | K1=9.1×10-8 K2=1.1×10-12 |
①常温下,pH相同的三种溶液NaF、Na2CO3、Na2S,物质的量浓度最大的是____。
②将过量H2S通入Na2CO3溶液,反应的离子方程式是____。
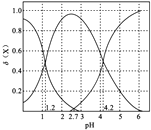
(2)二元弱酸H2A溶液中H2A、HA-、A2-的物质的量分数δ(X)随pH的变化如图所示。则H2A的电离平衡常数K1=____。
(3)室温下,用0.100 mol·L-1盐酸溶液滴定20.00 mL 0.l00 mol·L-1的氨水溶液,滴定曲线如图所示。(忽略溶液体积的变化)
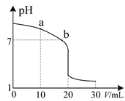
①a点所示的溶液中c(NH3·H2O)____c(Cl-)。
②b点所示的溶液中c(Cl-)____c(NH![]() )。
)。
③pH =10的氨水与pH=4的NH4C1溶液中,由水电离出的c(H+)之比为____。
(4)常温下,要将ZnSO4溶液中的Zn2+沉淀完全(Zn2+的浓度小于10-5 mol·L-1),应控制溶液的pH____。(已知25℃时,Ksp[Zn(OH)2] =1.0×l0-17)
【题目】电解质溶液中存在多种平衡。请回答下列问题:
(1)已知:
化学式 | CH3COOH | HClO |
电离常数(25℃) | 1.8×10-5 | 3.0×10-8 |
物质的量浓度均为0.1mol/L的下列溶液:a. CH3COOH b. HClO ,比较二者C(H+)的大小:a______b(填“>”、“<”或“=”)。
(2)常温下,将 0.1mol/L 的 CH3COOH 溶液加水稀释,在稀释过程中,下列表达式的数值变大的 __________(填字母)。
A. c(H+) B.  C. c(H+)·c(OH-)
C. c(H+)·c(OH-)
(3)25℃时,体积均为 10mL,pH 均为 2 的醋酸溶液与一元酸 HX 溶液分别加水稀释至 1000mL,稀释过程中 pH 的变化如图所示。已知:pH= -lgC(H+),则:

①25℃时,醋酸的电离常数________HX的电离常数。(填“>”、“<”或“=”)
②稀释100倍后, 醋酸溶液中由水电离出的 c(H+)________ HX溶液中由水电离出的c(H+)。(填“>”、“<”或“=”)