题目内容
4.下列说法中正确的是( )| A. | 完全由非金属组成的化合物不一定是共价化合物 | |
| B. | 构成分子晶体的粒子一定含有共价键 | |
| C. | 分子晶体的熔点一定比金属晶体的熔点低 | |
| D. | 含有金属离子的晶体一定是离子晶体 |
分析 A.完全由非金属组成的化合物,可能为共价化合物,也可能为离子化合物;
B.稀有气体形成的晶体为分子晶体;
C.一般金属晶体的熔点比分子晶体高;
D.含有金属离子的晶体可能为金属晶体.
解答 解:A.完全由非金属组成的化合物,如HCl为共价化合物,NH4Cl为离子化合物,则完全由非金属组成的化合物不一定是共价化合物,故A正确;
B.稀有气体形成的晶体为分子晶体,不含化学键,故B错误;
C.一般金属晶体的熔点比分子晶体高,如W的熔点很高,故C错误;
D.含有金属离子的晶体可能为金属晶体,也可能为离子晶体,故D错误;
故选A.
点评 本题考查化学键及化合物的类别,为高频考点,把握常见物质中的化学键及形成化学键的一般规律、晶体类型及熔点比较为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
14.臭氧是理想的烟气脱硝剂,其脱销反应为:2NO2(g)+O3(g)?N2O5(g)+O2(g),在T温度下,向2.0L恒容密闭容器中充入2.0molNO2和1.0molO3,经过一段时间后达到平衡,反应过程中测定的部分数据见下表:
下列有关说法正确的是( )
| t/s | 0 | 3 | 6 | 12 | 24 |
| n(O2)/mol | 0 | 0.36 | 0.60 | 0.80 | 0.80 |
| A. | 反应在0~3s的平均速率为v(NO2)=0.24mol•L-1•s-1 | |
| B. | 24s后,若保持其他条件不变,降低温度,达到新平衡时测得c(O2)=0.44mol•L-1,则反应的△H<0 | |
| C. | 在T温度下,起始时向容器中充入1.0molNO2、0.5molO3和0.50molN2O5、0.50molO2,反应达到平衡时,压强为起始的0.88倍 | |
| D. | 在T温度下,起始时向容器中充入2.0molN2O5和2.0molO2,达到平衡时,N2O5的转化率大于20% |
15.下列仪器中,能在酒精灯上直接加热的是( )
| A. | 试管 | B. | 烧杯 | C. | 量筒 | D. | 集气瓶 |
19.硫酸亚铁溶液含有杂质硫酸铜和硫酸铁,为除去杂质,提纯硫酸亚铁,应该加入下列哪种物质( )
| A. | 锌粉 | B. | 镁粉 | C. | 铁粉 | D. | 铝粉 |
9.元素A的原子最外层有6个电子,元素B的原子最外层有3个电子,则A与B形成的化合物可能的化学式是( )
| A. | B2A3 | B. | B2A | C. | BA2 | D. | BA |
16.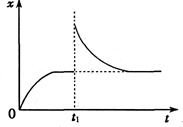 往某恒温密闭容器中加入CaCO3,发生反应:CaCO3(s)?CaO(s)+CO2(g)△H>0.反应达到平衡后,t1时,缩小容器体积,x随时间(t)变化的关系如右图所示.x不可能是( )
往某恒温密闭容器中加入CaCO3,发生反应:CaCO3(s)?CaO(s)+CO2(g)△H>0.反应达到平衡后,t1时,缩小容器体积,x随时间(t)变化的关系如右图所示.x不可能是( )
 往某恒温密闭容器中加入CaCO3,发生反应:CaCO3(s)?CaO(s)+CO2(g)△H>0.反应达到平衡后,t1时,缩小容器体积,x随时间(t)变化的关系如右图所示.x不可能是( )
往某恒温密闭容器中加入CaCO3,发生反应:CaCO3(s)?CaO(s)+CO2(g)△H>0.反应达到平衡后,t1时,缩小容器体积,x随时间(t)变化的关系如右图所示.x不可能是( )| A. | v逆 | B. | c(CO2) | C. | △H | D. | ρ(容器内气体密度) |
14.下列反应的离子方程式书写错误的是( )
| A. | Ca(HCO3)2溶液中加入足量的Ba(OH)2溶液:Ca2++2HCO3-+Ba2++2OH-=CaCO3↓+BaCO3↓+2H2O | |
| B. | 3molCl2通入含2molFeI2的溶液中:2Fe2++4I-+3Cl2=2Fe3++6Cl-+2I2 | |
| C. | 往Ba(OH)2溶液中逐滴加入NH4Al(SO4)2溶液,可能发生反应的离子方程式是Al3++SO42-+Ba2++3OH-=BaSO4↓+Al(OH)3↓ | |
| D. | 向苯酚钠溶液中通入少量的CO2: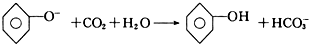 |
 .
.