题目内容
11.下列工业生产的主要反应中,涉及置换反应的是( )| A. | 制取粗硅 | B. | 海水提镁 | C. | 电解制铝 | D. | 制备硫酸 |
分析 A.制取粗硅,涉及C与二氧化硅反应;
B.海水提镁,利用复分解反应将镁离子转化为氢氧化镁,氢氧化镁与盐酸反应生成氯化镁,电解熔融氯化镁冶炼Mg;
C.电解熔融氧化铝冶炼Al;
D.硫铁矿燃烧生成二氧化硫,二氧化硫催化氧化生成三氧化硫,三氧化硫与水反应生成硫酸.
解答 解:A.制取粗硅,涉及C与二氧化硅反应,C与二氧化硅反应生成Si和CO,为置换反应,故A选;
B.海水提镁,利用复分解反应将镁离子转化为氢氧化镁,氢氧化镁与盐酸反应生成氯化镁,电解熔融氯化镁冶炼Mg,涉及复分解反应、分解反应,故B不选;
C.电解熔融氧化铝冶炼Al,氧化铝电解生成Al和氧气,为分解反应,故C不选;
D.硫铁矿燃烧生成二氧化硫,二氧化硫催化氧化生成三氧化硫,三氧化硫与水反应生成硫酸,涉及氧化还原反应、化合反应,故D不选;
故选A.
点评 本题考查物质制备中的反应类型,为基础性习题,把握发生的反应及制备原理为解答的关键,侧重分析与应用能力的考查,题目难度中等.

练习册系列答案
相关题目
1.下列离子方程式正确的是( )
| A. | 铁与稀硝酸反应:Fe+2H+=Fe2++H2↑ | |
| B. | CuSO4与Ba (OH)2溶液混合 Cu2++SO42-+2OH-+Ba2+=BaSO4↓+Cu(OH)2↓ | |
| C. | 氯化钙与碳酸氢钾溶液混合:Ca2++CO32-=CaCO3↓ | |
| D. | 小苏打与氢氧化钠溶液混合:HCO3-+OH-=CO2↑+H2O |
2.下列有关氧气的实验,正确的是( )
| A. |  制取氧气 | B. |  收集氧气 | ||
| C. |  干燥氧气 | D. |  铁丝在氧气中燃烧 |
19.硫酸亚铁溶液含有杂质硫酸铜和硫酸铁,为除去杂质,提纯硫酸亚铁,应该加入下列哪种物质( )
| A. | 锌粉 | B. | 镁粉 | C. | 铁粉 | D. | 铝粉 |
6.某物质的晶体中,含A、B、C三种元素,其排列方式如图所示(其中前后两面心上的B原子未画出).晶体中的A、B、C的原子个数比依次为( )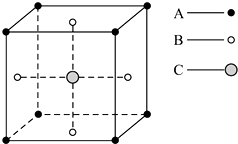

| A. | 1:3:1 | B. | 2:3:1 | C. | 2:2:1 | D. | 1:3:3 |
16. 往某恒温密闭容器中加入CaCO3,发生反应:CaCO3(s)?CaO(s)+CO2(g)△H>0.反应达到平衡后,t1时,缩小容器体积,x随时间(t)变化的关系如右图所示.x不可能是( )
往某恒温密闭容器中加入CaCO3,发生反应:CaCO3(s)?CaO(s)+CO2(g)△H>0.反应达到平衡后,t1时,缩小容器体积,x随时间(t)变化的关系如右图所示.x不可能是( )
 往某恒温密闭容器中加入CaCO3,发生反应:CaCO3(s)?CaO(s)+CO2(g)△H>0.反应达到平衡后,t1时,缩小容器体积,x随时间(t)变化的关系如右图所示.x不可能是( )
往某恒温密闭容器中加入CaCO3,发生反应:CaCO3(s)?CaO(s)+CO2(g)△H>0.反应达到平衡后,t1时,缩小容器体积,x随时间(t)变化的关系如右图所示.x不可能是( )| A. | v逆 | B. | c(CO2) | C. | △H | D. | ρ(容器内气体密度) |
3.下列结论错误的是( )
①微粒半径:K+>Al3+>S2->Cl-
②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③离子的还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO4
⑥非金属性:O>N>P>Si
⑦金属性:Be<Mg<Ca<K
⑧沸点:H2Se>H2S>H2O.
①微粒半径:K+>Al3+>S2->Cl-
②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③离子的还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO4
⑥非金属性:O>N>P>Si
⑦金属性:Be<Mg<Ca<K
⑧沸点:H2Se>H2S>H2O.
| A. | ①⑤ | B. | ①③⑤⑧ | C. | ②④⑥⑦ | D. | ②④⑥ |
20.用NA一表示阿伏加德罗常数的值.下列判断错误的是( )
| A. | NA个H+的质量为1g | |
| B. | 32g O2中含有2NA个O原子 | |
| C. | 2 L 0.5mol/LNa2SO4溶液中含NA个Na+ | |
| D. | 标准状况下,1 molH2O中含有10NA个质子 |
1.元素周期表中某区域的一些元素多用于制造半导体材料,它们是( )
| A. | 左、下方区域的金属元素 | |
| B. | 右、上方区域的非金属元素 | |
| C. | 金属元素与非金属元素分界线附近的元素 | |
| D. | 过渡元素中 |