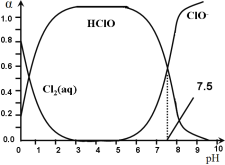
题目内容
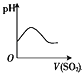
【题目】海底蕴藏着丰富的锰结核矿,其主要成分是MnO2。1991年由Allen等人研究,用硫酸淋洗后使用不同的方法可制备纯净的MnO2,其工艺流程如图所示:
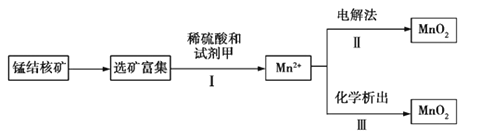
已知:化学析出时用NaClO3作析出试剂,每生成0.05 mol MnO2时消耗0.02 mol NaClO3。
根据以上工艺流程及信息,判断下列说法不正确的是
A.步骤Ⅰ中的试剂甲必须具有较强的还原性
B.步骤Ⅲ发生反应的离子方程式为2ClO3—+5Mn2++4H2O=5MnO2+Cl2+8H+
C.若用电解法,则MnO2将在阳极产生,电极反应式为Mn2+-2e-+2H2O=MnO2+4H+
D.测定步骤Ⅰ所得溶液中Mn2+的含量可采用先将Mn2+转化为Mn,然后再用0.1 mol·L-1 HCl标准溶液滴定的方法
【答案】D
【解析】
A. 步骤I中,Mn元素的化合价由+4价降低为+2价,则试剂甲应具有还原性,A正确;
根据已知条件,步骤Ⅲ中,用NaClO3作析出试剂,是利用NaClO3的氧化性,生成0.05 mol B. MnO2消耗0.02 mol NaClO3,由得失电子守恒知,NaClO3的还原产物为Cl2,离子方程式为2ClO3—+5Mn2++4H2O=5MnO2+Cl2+8H+,B正确;
C. 根据图示,Mn元素的化合价由+2价降低为+4价,发生氧化反应,用电解法,阳极发生氧化反应,则MnO2将在阳极产生,电极反应式为Mn2+-2e-+2H2O=MnO2+4H+,C正确;
D. 不能用盐酸来滴定Mn,D错误。

 名校课堂系列答案
名校课堂系列答案【题目】某同学用滤纸折成一个纸蝴蝶,并喷洒一种溶液(保持湿润),挂在铁架台上,将盛某种溶液的烧杯放在纸蝴蝶的下方,如图所示。向烧杯中加入另一种物质,过一会儿发现纸蝴蝶变为红色且保持红色不变,下面的组合能够实现上述变化的是( )
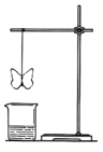
A | B | C | D | |
纸蝴蝶上的喷洒液 | 石蕊 | 酚酞 | 酚酞 | 石蕊 |
烧杯中的溶液 | 浓硫酸 | 氯化铵 | 稀硫酸 | 高锰酸钾 |
加入烧杯中的物质 | 铜 | 氢氧化钠浓溶液 | 氨水 | 浓盐酸 |
A.AB.BC.CD.D