题目内容
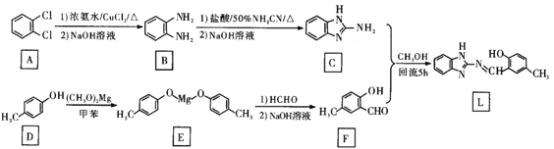
【题目】已知铜和浓硫酸可以在加热条件下发生如下反应(反应方程式已配平):Cu+2H2SO4(浓) ![]() CuSO4+X↑+2H2O试通过计算和推理回答下面的问题:
CuSO4+X↑+2H2O试通过计算和推理回答下面的问题:
(1)X物质可以导致酸雨的形成,X应该属于________(填字母代号)。
a.酸 b.碱 c.盐 d.酸性氧化物 e.碱性氧化物
(2)X物质可以使酸性KMnO4溶液褪色,该过程中(填化学式,下同)______失去电子,氧化剂是______。
(3)足量的铜片与20mL18mol·L-1的浓H2SO4充分反应,如果该反应过程中转移了0.2mol电子,生成的CuSO4的物质的量为______mol,生成的X气体在标准状况下体积为______L(假设气体全部逸出)。
(4)将(3)反应后得到的溶液与过量Ba(OH)2溶液混合,充分反应,反应后所得沉淀的质量为______g。
【答案】d ![]()
![]() 0.1 2.24 70.38
0.1 2.24 70.38
【解析】
足量的铜片与20mL18mol·L-1的浓H2SO4混合,发生反应Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O,虽然反应物与生成物中间用“==”,但由于稀硫酸与铜不反应,所以铜和硫酸都有剩余。在进行硫酸铜生成量的计算时,我们既不能利用铜,也不能利用硫酸进行计算。
CuSO4+SO2↑+2H2O,虽然反应物与生成物中间用“==”,但由于稀硫酸与铜不反应,所以铜和硫酸都有剩余。在进行硫酸铜生成量的计算时,我们既不能利用铜,也不能利用硫酸进行计算。
(1)对于Cu+2H2SO4(浓)![]() CuSO4+X↑+2H2O,利用质量守恒定律,可求出X的化学式为SO2,X应该属于酸性氧化物;
CuSO4+X↑+2H2O,利用质量守恒定律,可求出X的化学式为SO2,X应该属于酸性氧化物;
答案为:d;
(2)SO2可以使酸性KMnO4溶液褪色,则SO2作还原剂,该过程中SO2失去电子,氧化剂是KMnO4;
答案为:SO2;KMnO4;
(3)足量的铜片与20mL18mol·L-1的浓H2SO4充分反应,则存在下列关系式:Cu—2e-—H2SO4—CuSO4—SO2;该反应过程中转移了0.2mol电子,则n(CuSO4)=n(SO2)=![]() n(e-)=0.1mol,V(SO2)=0.1mol×22.4L/mol=2.24L;
n(e-)=0.1mol,V(SO2)=0.1mol×22.4L/mol=2.24L;
答案为:0.1;2.24;
(4)由上面计算可知,在铜与浓硫酸的反应中,n(Cu2+)=n(H2SO4)氧化性=0.1mol,从而得出溶液中n(SO42-)=0.020L×18mol/L-0.1mol=0.26mol;与过量Ba(OH)2溶液混合,发生如下反应:Cu2++2OH-=Cu(OH)2↓,Ba2++ SO42-= BaSO4↓,从而得出n[Cu(OH)2]=0.1mol,n(BaSO4)= 0.26mol,m(沉淀)=m[Cu(OH)2]+m(BaSO4)= 0.1mol×98g/mol+0.26mol×233g/mol=70.38g;
答案为:70.38。

 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案【题目】丙烯酸甲酯(CH2=CHCOOCH3)是一种重要的有机化工原料。实验室制备少量丙烯酸甲酯的反应为:CH2=CHCOOH+CH3OH![]() CH2=CHCOOCH3+H2O,步骤如下:
CH2=CHCOOCH3+H2O,步骤如下:
步骤1:在100mL圆底烧瓶中依次加入10.0g丙烯酸、少许碎瓷片、10mL甲醇和2mL浓硫酸,搅拌。
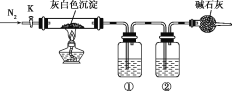
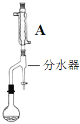
步骤2:如图,连接装置,加热烧瓶中的混合液,用锥形瓶盛接通过分水器分离出的水。当不再有水生成,停止加热。
步骤3:反应液冷却后,依次用5%Na2CO3溶液、饱和食盐水、水洗涤。分离出有机相。
步骤4;向有机相中加无水Na2SO4固体,过滤后蒸馏,收集70~90℃馏分。测得丙烯酸甲酯的质量为6.45g。
可能用到的信息:
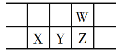
密度 | 沸点 | 溶解性 | ||
丙烯酸 | 1.05g·cm-3 | 141℃ | 与水互溶,易溶于有机溶剂 | 有毒 |
甲醇 | 0.79g·cm-3 | 65℃ | 与水互溶,易溶于有机溶剂 | 易挥发,有毒 |
丙烯酸甲酯 | 0.95g·cm-3 | 80.5℃ | 难溶于水,易溶于有机溶剂 | 易挥发 |
请回答下列问题:
(1)步骤1中,加入碎瓷片的目的是__。
(2)步骤2中,图中所示装置中仪器A的名称是__,其作用为__。
(3)步骤3中,用5%Na2CO3溶液洗涤后,分离有机相的操作名称为__。
(4)实验中可能生成的有机副产物结构简式为__(填一种即可)。
(5)本实验中丙烯酸甲酯的产率为__%。