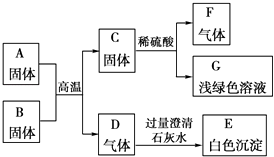
题目内容
【题目】煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1)将水蒸气通过红热的炭即可产生水煤气,热化学方程式为:C(s)+H2O(g)![]() CO(g)+H2(g) ΔH=+131.3 kJ·mol-1。能使化学反应速率加快的措施有________(填序号)。
CO(g)+H2(g) ΔH=+131.3 kJ·mol-1。能使化学反应速率加快的措施有________(填序号)。
①增大C的物质的量
②升高反应温度
③随时吸收CO、H2转化为CH3OH
④密闭定容容器中充入CO(g)
(2)将不同物质的量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下两组数据:
CO2(g)+H2(g),得到如下两组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | H2 | CO | |||
1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 2 |
①实验1中用CO2表示的化学反应速率为__________________。
②温度从650 ℃升高到900 ℃时,化学平衡常数会________(填“增大”“减小”或“不变”),则该反应的正反应为________(填“吸热”或“放热”)反应。
(3)在一容积为2 L的密闭容器内加入2 mol的CO和6 mol的H2,在一定条件下发生如下反应CO(g)+2H2(g)![]() CH3OH(g) ΔH<0,该反应的逆反应速率与时间的关系如图所示。
CH3OH(g) ΔH<0,该反应的逆反应速率与时间的关系如图所示。
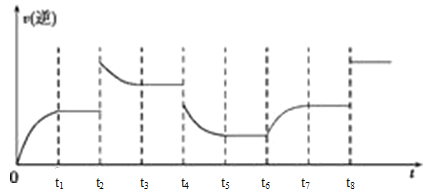
若t4时降压,t5时达到平衡,t6时改变的条件可能是____________。
【答案】 ② ④ 0.16 mol/(L·min) 减小 放热 增大反应物的浓度
【解析】(1)①C为固体,增大C的物质的量对速率无影响;②升高反应温度,速率加快;③随时吸收CO、H2转化为CH3OH,降低生成物浓度,速率降低;④密闭定容容器中充入CO(g),增大生成物浓度,速率加快。故选②④。
(2)①由实验1中数据分析,反应在5 min达到平衡,v(CO)=v(CO2)=(4 mol -2.4 mol)/2L/5 min=0.16 mol/(L·min);
②第二组温度比第一组高,反应物物质的量比第一组减半,但是平衡时CO2的物质的量比第一组的一半少,表明该反应为放热反应;温度从650 ℃升高到900 ℃时,化学平衡常数会减小;
(3)由图分析,t6时逆反应速率瞬间没有变化,然后慢慢升高,说明反应正向进行,应是增大反应物的浓度。

 阅读快车系列答案
阅读快车系列答案