题目内容
【题目】甲、乙、丙、X是中学化学中常见的4种物质,其转化关系如图,其中甲和X不可能是

A. 甲为C2H5OH、X为O2 B. 甲为H2S、X为O2
C. 甲为HNO3、X为Fe D. 甲为AlCl 3溶液、X为NaOH溶液
【答案】A
【解析】试题分析:A.C2H5OH和O2可生成乙醛,书写醛可氧化为乙酸,但乙酸不可以直接转化为乙醇,故A错误;B.甲为H2S和O2反应生成S,S和O2生成SO2,SO2和H2S反应生成S,故B正确;C.甲为HNO3、X为Fe生成硝酸铁,硝酸铁和铁反应生成硝酸亚铁,硝酸亚铁可被硝酸氧化为硝酸铁,故C正确;D.甲为AlCl 3溶液和NaOH溶液反应生成氢氧化铝,氢氧化铝与NaOH反应生成偏铝酸钠,偏铝酸钠与AlCl 3溶液反应生成氢氧化铝,故D正确;答案为A。

【题目】下表列出了A~R等9种元素在周期表中的位置;
IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
2 | E | F | ||||||
3 | A | C | D | G | R | |||
4 | B | H |
(1)写出下列元素的名称;A , C , E , R .
(2)D的原子结构示意图为 , 其最高价氧化物的水化物与氢氧化钠溶液反应的离子方程式是 .
(3)A、B、C三种元素的原子半径由大到小的顺序为(填元素符号),其最高价氧化物对应水化物的碱性由强到弱顺序为 . (填化学式)
(4)F元素的氢化物的电子式为 , 其中一种氢化物在常温下与MnO2混合的反应化学方程式为 .
(5)用电子式表示A与H形成化合物的过程为 , 高温灼伤该化合物时,火焰呈色.
【题目】利用右图装置测定中和热的实验步骤如下: 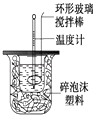
①用量筒量取50mL 0.25mol/L硫酸倒入小烧杯中,并测出其温度;
②用另一量筒量取50mL 0.55mol/L NaOH溶液,并测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度.
回答下列问题:
(1)写出稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式(中和热数值为57.3kJ/mol): .
(2)倒入NaOH溶液的正确操作是 .
A.沿玻璃棒缓慢倒入
B.分三次少量倒入
C.一次迅速倒入
(3)实验数据如表:
①请填写下表中的空白:
温度 | 起始温 | 终止温度t2/℃ | 温度差平均值 | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
3 | 26.4 | 26.2 | 26.3 | 29.8 | |
②近似认为0.55mol/L NaOH溶液和0.25mol/L硫酸溶液的密度都是1g/cm3 , 中和后生成溶液的比热容c=4.18J/(g℃).则中和热△H=( 保留一位小数).
