题目内容
【题目】已知下列两个热化学方程式:
H2(g)+ ![]() O2(g)═H2O(l)△H=﹣285kJ/mol
O2(g)═H2O(l)△H=﹣285kJ/mol
C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=﹣2220.0kJ/mol
(1)实验测得H2和C3H8的混合气体共3mol完全燃烧生成液态水时放热2790kJ,则混合气体中H2和C3H8的体积比为 .
(2)已知:H2O(l)═H2O(g)△H=+44.0kJ/mol,写出丙烷燃烧生成CO2和气态水的热化学方程式: .
【答案】
(1)2:1
(2)C3H8(g)+5O2(g)═3CO2(g)+4H2O(g)△H=﹣2044kJ/mol
【解析】解:(1)由热化学方程式可知,氢气的燃烧热为285kJ/mol,丙烷的燃烧热为2220.0kJ/mol.H2和C3H8的混合气体共3mol,完全燃烧生成液态水时放热2790kJ,则混合气体中H2和C3H8的平均燃烧热为 ![]() =930kJ/mol,根据十字交叉法计算H2和C3H8的体积比:
=930kJ/mol,根据十字交叉法计算H2和C3H8的体积比: 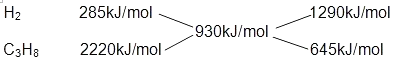 故H2和C3H8的体积比为1290kJ/mol:645kJ/mol=2:1.所以答案是:2:1.(2)已知:①C3H8(g)+5O2(g)═3CO2(g)+4H2O(1);△H=﹣2220.0kJ/mol②H2O(1)=H2O(g);△H=+44.0kJ/mol由盖斯定律可知,①+②×4得C3H8(g)+5O2(g)═3CO2(g)+4H2O(g)△H=﹣2044kJ/mol,所以答案是:C3H8(g)+5O2(g)═3CO2(g)+4H2O(g)△H=﹣2044kJ/mol.
故H2和C3H8的体积比为1290kJ/mol:645kJ/mol=2:1.所以答案是:2:1.(2)已知:①C3H8(g)+5O2(g)═3CO2(g)+4H2O(1);△H=﹣2220.0kJ/mol②H2O(1)=H2O(g);△H=+44.0kJ/mol由盖斯定律可知,①+②×4得C3H8(g)+5O2(g)═3CO2(g)+4H2O(g)△H=﹣2044kJ/mol,所以答案是:C3H8(g)+5O2(g)═3CO2(g)+4H2O(g)△H=﹣2044kJ/mol.

【题目】(1)某温度时,在3L密闭容器中进行的某一可逆反应,该反应中的X、Y、Z三种物质的物质的量随时间变化的曲线如下图所示。由图中数据分析:

①该反应的化学方程式:______________________。
②反应开始至3min末,Z的反应速率为_____________________。
③该反应是由_____________开始反应的。(填“正反应”、“逆反应”或“正、逆反应同时”)
(2)将SO2、O2在某密闭容器中混合,在450 ℃发生反应:2SO2(g)+O2(g) ![]() SO3(g)。
SO3(g)。
①增大压强,则正反应速率________(填:增大、减小或不变,下同),逆反应速率________。
②维持容器容积不变,加入0.1 mol SO2的一瞬间,正反应速率________,逆反应速率________;若加入的是0.1 mol He,则正、逆反应速率________。
③若维持容器压强不变,加入0.1 mol He后,容器的容积________,物质的浓度________,反应速率________。
(3)在100℃时,将0.100mol N2O4气体充入1L恒容抽空的密闭容器中,隔一定时间对该容器内物质的浓度进行分析得到如表数据:
时间(s) | 0 | 20 | 40 | 60 | 80 |
c(N2O4)/mol·L-1 | 0.100 | c1 | 0.050 | c3 | c4 |
c(NO2)/mol·L-1 | 0.000 | 0.060 | c2 | 0.120 | 0.120 |
①该反应的平衡常数表达式为___________;从表中分析:c1___________c2, c3___________c4(填“>”、“<”或“=”)。
②在上述条件下,从反应开始直至达到化学平衡时,N2O4的平均反应速率为________mol·L-1·s-1
③若在相同条件下,起始时只充入0.080 mol NO2气体,则达到平衡时NO2气体的转化率为_________。




