��Ŀ����
����Ŀ������ʱ���о�pH��һ��Ũ��FeSO4���ȶ��Ե�Ӱ�죬������ͼ��������������

A. pHС��1ʱ��������������ģ����ܵ�ԭ����4Fe2++ O2+ 10H2O![]() 4Fe(OH)3 + 8H+ƽ�������ƶ�
4Fe(OH)3 + 8H+ƽ�������ƶ�
B. pH��3.0~5.5֮�䣬pH�ı仯��FeSO4�ȶ���Ӱ�첻��
C. pH����6.5ʱ�����������ͻ�䣬���ܵ�ԭ�������ɵ�Fe(OH) 2���ױ�����
D. ����������ͬʱ��FeSO4��Һ�м�������(NH4)2SO4���壬FeSO4���ȶ��Լ���
���𰸡�D
��������A��Fe2+����O2��Ӧ����Ӧ����ʽΪ4Fe2++O2+10H2O4Fe(OH)3+8H+��pHС��1ʱ��c(H+)Ũ�Ƚϴ�Ӧ������У�Fe2+��������ģ���A��ȷ��B����ͼ��֪��pH��3.0��5.5֮�䣬Fe2+��������������䣬˵��pH��3.0��5.5֮�䣬pH�仯��FeSO4�ȶ���Ӱ�첻��B��ȷ��C��pH����6.5ʱ��c(H+)Ũ�Ƚ�С�����������ͻ�䣬����ԭ�������Լ�����2�������ױ���������C��ȷ��D������������ͬʱ��FeSO4��Һ�м�������(NH4)2SO4���壬NH4+ˮ�⣬c(H+)Ũ������4Fe2++O2+10H2O4Fe(OH)3+8H+������У�����Fe2+�ı�������FeSO4���ȶ�����ǿ����D����ѡD��

 ���źþ���Ԫ����ĩ��ϵ�д�
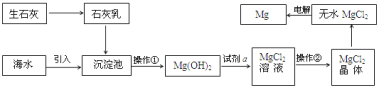
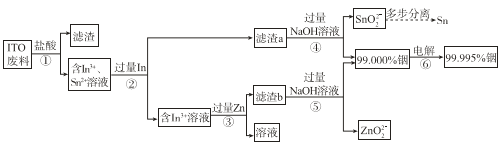
���źþ���Ԫ����ĩ��ϵ�д�����Ŀ���ӷϾ�Һ����ʾ�������� ITO����Ҫ�ɷ��Ǻ������������������������������ʾ��ͼ���¡�
���ϣ�
���� | ����In�� | ����Sn�� |
���ڱ�λ�� | �������ڡ���IIIA�� | �������ڡ���IVA�� |
��ɫ��״̬ | ����ɫ���� | ����ɫ���� |
���������� | ������Ӧ | ������Ӧ |
��ǿ����Һ | ����Ӧ | ��Ӧ |
��1��Ϊ�˼ӿ첽��ٵķ�Ӧ���ʣ����Բ�ȡ�Ĵ�ʩ��______�����ٴ����㣩��
��2�������������������ת����In3+�����ӷ���ʽ��______��
��3��������м���������ܹ���ȥ��Һ�е�Sn2+�������������Ϸ�����ԭ����______��
��4������ܺ͢���NaOH��Һ��������______��
��5����ͼ��ģ�⾫������װ��ͼ�����ڷ�������д��Ӧ�����ʡ�_____