题目内容
【题目】无机或有机含氧酸分子去掉一个或多个羟基后剩余结构称为酰基,如“—SO2—”称为硫酰(基),SOCl2、SO2Cl2、COCl2分别称为亚硫酰氯、硫酰氯和碳酰氯,它们都有很多相似的性质,如都能发生水解反应生成对应的酸、都可作氯化剂等。回答下列问题:
(1)已知:SO2(g)+PCl5(s)![]() SOCl2(l)+POCl3(l) ΔH1=a kJ·mol1
SOCl2(l)+POCl3(l) ΔH1=a kJ·mol1
PCl5(s)+H2O(l)![]() POCl3(l)+2HCl(g) ΔH2=b kJ·mol1
POCl3(l)+2HCl(g) ΔH2=b kJ·mol1
则反应SOCl2(l)+H2O(l)![]() SO2(g)+2HCl(g) ΔH3=_________ kJ·mol1(用含a、b的代数式表示)。
SO2(g)+2HCl(g) ΔH3=_________ kJ·mol1(用含a、b的代数式表示)。
(2)①在1 L的密闭容器中充入1 mol SO2和2 mol Cl2,发生反应:SO2(g)+Cl2(g)![]() SO2Cl2(l)。
SO2Cl2(l)。
反应达平衡后,其他条件不变,减小压强,请在下图中画出改变条件后反应速率随时间的变化曲线图。

②再次达平衡后测得SO2的转化率为35%。反应后向密闭容器中注入足量的BaCl2溶液,最终生成沉淀的质量为__________g。
(3)一定条件下存在反应:CO(g)+Cl2(g)![]() COCl2(g)ΔH=108 kJ·mol1,现有3个体积均为
COCl2(g)ΔH=108 kJ·mol1,现有3个体积均为
10 L的密闭容器Ⅰ、Ⅱ、Ⅲ,按如下所示投料,并在150℃条件下开始反应达平衡。
密闭容器Ⅰ(绝热恒容):1 mol CO,1 mol Cl2
密闭容器Ⅱ(恒温恒容):1 mol COCl2
密闭容器Ⅲ(恒温恒容):1 mol CO,1 mol Cl2
①容器Ⅰ中CO的转化率与容器Ⅱ中COCl2的转化率之和_____________(填“>”“<”或“=”)1;容器Ⅱ反应的化学平衡常数为K1,容器Ⅲ的化学平衡常数为K2,K1与K2的关系为_____________。
②容器Ⅲ中反应前总压强为1 atm,反应后的总压强为0.75 atm,则反应的平衡常数Kp=_________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
【答案】(15分)
(1)ba(2分)
(2)①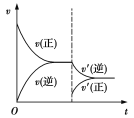 (3分) ②233(3分)
(3分) ②233(3分)
(3)①<(2分) K1·K2=1(或K1=![]() )(2分) ②4 atm1(或“4”)(3分)
)(2分) ②4 atm1(或“4”)(3分)
【解析】(1)SO2(g)+PCl5(s) ![]() SOCl2(l)+POCl3(l) ΔH1=a kJ·mol1①,PCl5(s)+H2O(l)
SOCl2(l)+POCl3(l) ΔH1=a kJ·mol1①,PCl5(s)+H2O(l) ![]() POCl3(l)+2HCl(g) ΔH2=b kJ·mol1②,反应②反应①得SOCl2(l)+H2O(l)
POCl3(l)+2HCl(g) ΔH2=b kJ·mol1②,反应②反应①得SOCl2(l)+H2O(l)![]() SO2(g)+2HCl(g),ΔH=ΔH2ΔH1=(b-a) kJ·mol1。(2)①由于生成物中只有液态的SO2Cl2,因此减小压强的瞬间逆反应速率不变,正反应速率减小,平衡逆向移动。②反应后注入足量BaCl2溶液的过程中发生的相关反应有SO2Cl2+2H2O
SO2(g)+2HCl(g),ΔH=ΔH2ΔH1=(b-a) kJ·mol1。(2)①由于生成物中只有液态的SO2Cl2,因此减小压强的瞬间逆反应速率不变,正反应速率减小,平衡逆向移动。②反应后注入足量BaCl2溶液的过程中发生的相关反应有SO2Cl2+2H2O![]() H2SO4+2HCl,SO2+Cl2+2H2O
H2SO4+2HCl,SO2+Cl2+2H2O![]() H2SO4+2HCl,H2SO4+BaCl2
H2SO4+2HCl,H2SO4+BaCl2![]() BaSO4↓+2HCl,由硫元素守恒得n(BaSO4)=1 mol,质量为233 g。(3)①若装置Ⅰ为恒温恒容,则转化率之和等于1,由于装置Ⅰ绝热,而该反应是放热反应,随着反应的进行温度升高不利于CO转化,因此两者之和小于1。容器Ⅱ与容器Ⅲ的平衡状态相同,初始反应方向相反,化学平衡常数互为倒数。②根据压强之比等于物质的量之比可知反应后容器内气体的物质的量为1.5 mol,可知平衡后n(CO)=n(Cl2)=n(COCl2)=0.5 mol,平衡分压各为0.25 atm,Kp=
BaSO4↓+2HCl,由硫元素守恒得n(BaSO4)=1 mol,质量为233 g。(3)①若装置Ⅰ为恒温恒容,则转化率之和等于1,由于装置Ⅰ绝热,而该反应是放热反应,随着反应的进行温度升高不利于CO转化,因此两者之和小于1。容器Ⅱ与容器Ⅲ的平衡状态相同,初始反应方向相反,化学平衡常数互为倒数。②根据压强之比等于物质的量之比可知反应后容器内气体的物质的量为1.5 mol,可知平衡后n(CO)=n(Cl2)=n(COCl2)=0.5 mol,平衡分压各为0.25 atm,Kp=![]() =
=![]() =4 atm1。
=4 atm1。

 名校课堂系列答案
名校课堂系列答案【题目】T℃时,将A和B各0.32 mol充入恒容密闭容器中,发生反应:A(g)+B(g)![]() 2C(g) △H=-a kJ·mol-1 (a>0),反应过程中测定的数据如下表,下列说法正确的是( )
2C(g) △H=-a kJ·mol-1 (a>0),反应过程中测定的数据如下表,下列说法正确的是( )
t/min | 0 | 2 | 4 | 7 | 9 |
n(B)/mol | 0.32 | 0.24 | 0.22 | 0.20 | 0.20 |
A.若起始时向容器中充入0.64 mol C,则达平衡时吸收的热量为0.12a kJ
B.恒温, 如果压缩容器体积,B的浓度和体积分数均不变
C.若起始时向容器中充入 0.64 mol A 和 0.64 mol B, 则达平衡时 n(C)<0.40 mol
D.恒温、恒容,向平衡体系中再充入0.32 mol A,再次平衡时,B的转化率增大
【题目】X、Y、Z、W、R是元素周期表前四周期中的常见元素,其相关信息如下表:
元素 | 相关信息 |
X | 组成蛋白质的基础元素,其最高正化合价与最低负化合价的代数和为2 |
Y | 地壳中含量最高的元素 |
Z | 存在质量数为23,中子数为12的核素 |
W | 生活中大量使用其合金制品,工业上可用电解熔融氧化物的方法制备其单质 |
R | 有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
(1)R在元素周期表中的位置为______;X、Z、W三种元素的原子半径从大到小的顺序是________(用元素符号表示)。
(2)X与氢两元素按原子数目比1∶3和2∶4构成分子A和B,A的催化氧化方程式为_______;B的结构式为_______;化合物Z2Y中存在的化学键类型为________。
(3)W溶于Z的最高价氧化物的水化物的离子方程式_______________。
(4)用RCl3溶液腐蚀铜线路板的离子方程式为______。检验溶液中R3+常用的试剂是________,可以观察到的现象是________________。



