题目内容
12.有关化学反应的方向和速率的研究可以指导化工生产.下列说法正确的是( )| A. | N2+3H2?高温、高压催化剂2NH3△H<0,在任何温度下均为自发反应 | |
| B. | 向新制氯水中加入少量小苏打固体可提高其漂白能力 | |
| C. | 1L密闭容器中发生反应4NH3+5O2?4NO+6H2O,充少量 N2可加快反应速率 | |
| D. | 湿法炼铜的反应为Fe+CuSO4=FeSO4+Cu,反应中的Fe可以用Na代替 |
分析 A、根据反应自发进行的判据:△H-T△S<0来判断;
B、向新制氯水中加入少量小苏打,碳酸氢钠可以和氯水中的盐酸发生反应,会使得化学平衡发生移动;
C、反应4NH3+5O2?4NO+6H2O充入少量N2不影响反应各个组分的浓度;
D、金属钠和盐溶液反应是先和其中的水反应,不会将金属从其盐中置换出来,据此回答.
解答 解:A、N2+3H2?高温、高压催化剂2NH3△H<0,△S<0,根据反应自发进行的判据:△H-T△S<0,该反应只有在低温下可以自发进行,故A错误;
B、氯水中存在平衡:Cl2+H2O?HCl+HClO,向新制氯水中加入少量小苏打,碳酸氢钠可以和氯水中的盐酸发生反应,促使化学平衡正向移动,所以次氯酸的浓度会增大,所以可提高其漂白能力,故B正确;
C、1L密闭容器中发生反应4NH3+5O2?4NO+6H2O,充少量 N2,不影响反应各个组分的浓度,化学反速率不会发生变化,故C错误;
D、金属钠和硫酸铜盐溶液反应是先和其中的水反应,不会将金属Cu从其盐中置换出来,故D错误.
故选B.
点评 本题综合考查学生反应自发性的判断、化学平衡移动原理、影响化学反应速率的因素以及金属钠的化学性质等知识,属于综合知识的考查,难度中等.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
12.从甜橙的芳香油中可分离得到如右图结构的化合物: ,能与该化合物中所有官能团都发生反应的试剂有( )
,能与该化合物中所有官能团都发生反应的试剂有( )
 ,能与该化合物中所有官能团都发生反应的试剂有( )
,能与该化合物中所有官能团都发生反应的试剂有( )| A. | 酸性KMnO4溶液 | B. | Ag(NH3)2OH溶液 | C. | 新制Cu(OH)2悬浊液 | D. | H2/Ni |
3.对于A2+3B2?2C的反应来说,以下化学反应速率的表示中,反应速度最快的是( )
| A. | v(B2)=0.8 mol/(L•s) | B. | v(B2)=3mol/(L•min) | C. | v(C)=0.6 mol/(L•s) | D. | v(A2)=0.4 mol/(L•s) |
20.下列实验装置和操作能达到实验目的是( )
| A. |  除去CO2中的HCl气体 | B. |  吸收NH3 | ||
| C. |  灼烧海带灰 | D. |  乙醇和水的分离 |
7.下列依据相关实验得出的结论正确的是( )
| 编号 | 实验 | 结论 |
| A | 向某溶液中加入稀盐酸,将产生的气体通入澄清石灰水,石灰水变浑浊 | 该溶液一定是碳酸盐溶液 |
| B | 用铂丝蘸取少量某溶液在酒精灯火焰上进行焰色反应,火焰呈黄色 | 该溶液不一定是钠盐溶液 |
| C | 往淀粉溶液中加稀硫酸,加热片刻,滴加银氨溶液并水浴加热,无银镜出现 | 该淀粉未发生水解 |
| D | 向某溶液中滴加KSCN 溶液,溶液不变色,滴加氯水后溶液显红色 | 该溶液中一定含Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
17.氮氧化铝(AlON)是一种透明高硬度防弹材料,可以由反应Al2O3+C+N2=2AlON+CO(高温)合成,下列有关说法正确的是( )
| A. | 氮氧化铝中氮的化合价是-3 | |
| B. | 反应中每生成5.7g AlON的同时生成1.12 L CO | |
| C. | 反应中氮气作氧化剂 | |
| D. | 反应中氧化产物和还原产物的物质的量之比是2:1 |
4.化学与社会生活密切相关,下列说法正确的是( )
| A. | 体积分数为95%的酒精通常作为医用酒精 | |
| B. | 石油的分馏、煤的气化、海水的提镁都包含化学变化 | |
| C. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| D. | 利用高纯度硅制造的太阳能电池板可将光能直接转化为电能 |
1.拟用如图装置制取如下表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热,a、b、c、d表示相应仪器中加入的试剂).能达到实验目的是( )
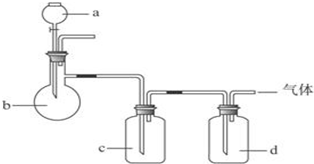

| 选项 | 气体 | a | b | c | d |
| A | SO2 | 硫酸 | 亚硫酸钠 | 浓硫酸 | NaOH溶液 |
| B | NH3 | 浓氨水 | 消石灰 | 浓硫酸 | H2O |
| C | O2 | 双氧水 | MnO2 | H2O | 浓硫酸 |
| D | Cl2 | 浓盐酸 | MnO2 | NaOH溶液 | 浓硫酸 |
| A. | A | B. | B | C. | C | D. | D |
2.有5种短周期元素在周期表中位置如图所示.已知:X的氢化物可用于刻蚀普通玻璃.下列推断正确的是( )
| | | G | | X |
| R | T | Y |
| A. | R和Y组成的化合物水溶液呈中性 | |
| B. | 最高价氧化物的水化物酸性:Y>G>X>R | |
| C. | 简单氢化物稳定性:X>Y>T | |
| D. | 常温下,TX4、TY4都呈液态 |