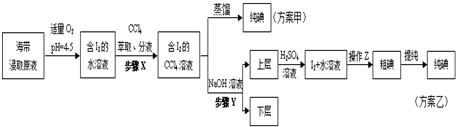
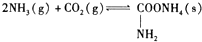题目内容
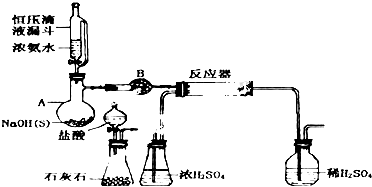
8.硝酸是一种重要的化工原料,氨氧化法是工业生产中制取硝酸的主要途径,关键反应为4NH3+5O2 $\frac{\underline{\;三氧化二铬\;}}{\;}$4NO+6H2O,某兴趣小组在实验室模拟氨氧化法制硝酸,实验装置如图所示,回答下列问题:(注:氯化钙可以与NH3反应生成八氨合氯化钙.)(1)仪器a的名称为球形干燥管,其中加的试剂为碱石灰.
(2)实验时先点燃C中的酒精灯,当催化剂Cr2O3由暗绿色变为微红时通入空气,3min后移去酒精灯,Cr2O3能保持红热状态的原因是该反应放热.
(3)装置D的作用是除去氨气和水蒸气;装置G的作用是吸收尾气.
(4)反应开始后,在装置E中看到的现象是气体变为红棕色.
(5)实验结束后,取F中溶液加入铜片,参加反应的硝酸中,被还原与未被还原的硝酸的物质的量之比:1:3;
(6)为测定所制硝酸的浓度,反应结束后取20mL 装置F中的液体,加水稀释至1000mL后,取出20mL加入锥形瓶中,滴加指示剂,然后用0.100mol/L的NaOH溶液滴定,用去25mL的NaOH溶液,则反应制得的硝酸的浓度为6.25 mol/L.若该溶液的密度为1.35g•cm-3,则溶液的质量分数为29.2%.
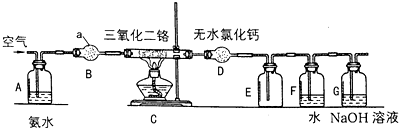
分析 (1)仪器a为球形干燥管,作用是干燥氧气和氨气的混合气体,应选用碱性干燥剂;
(2)移去酒精灯,Cr2O3固体保持红热说明反应放热;
(3)无水氯化钙是常用的干燥剂,同时氯化钙可以与NH3反应生成八氨合氯化钙;氢氧化钠溶液可以吸收酸性气体;
(4)一氧化氮与空气中的氧气反应生成二氧化氮;
(5)二氧化氮气体与水反应生成硝酸,根据铜与硝酸反应的方程式可知被还原与未被还原的硝酸的物质的量之比;
(6)根据氢氧化钠的物质的量计算硝酸的浓度,根据公式$ω=\frac{cM}{1000ρ}$可计算出硝酸溶液的质量分数;
解答 解:(1)仪器a为球形干燥管,作用是干燥氧气和氨气的混合气体,应选用碱性干燥剂碱石灰,
故答案为:球形干燥管,碱石灰;
(2)装置C中发生反应的化学反应是氨气的催化氧化反应生成一氧化氮和水,移去酒精灯,Cr2O3固体保持红热说明反应放热,
故答案为:该反应放热;
(3)氯化钙可以与NH3反应生成八氨合氯化钙,无水氯化钙是常用的干燥剂,故可以吸收氨气和水蒸气;装置G中盛放的是氢氧化钠溶液,可以吸收尾气,防治污染环境;
故答案为:除去氨气和水蒸气;吸收尾气;
(4)无色的一氧化氮与空气中的氧气反应生成红棕色的二氧化氮;
故答案为:气体变为红棕色;
(5)二氧化氮气体与水反应生成硝酸,根据铜与硝酸反应的方程式3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,可知被还原的硝酸生成了NO,未被还原的硝酸后来变成了硝酸铜,所以被还原与未被还原的硝酸的物质的量之比为1:3,
故答案为:1:3;
(6)反应制得的硝酸的浓度为$\frac{0.100mol/L×25mL}{20mL}$×$\frac{1000mL}{20mL}$=6.25mol/L,根据$ω=\frac{cM}{1000ρ}$可知,硝酸溶液的质量分数为$\frac{6.25×63}{1000×1.35}$×100%=29.2%,
故答案为:6.25;29.2%.
点评 本题以氨氧化法制取硝酸为载体考查物质制备的实验探究和物质性质的分析应用,侧重考查学生分析问题、解决问题的综合能力,题目难度中等.

| 温度/K | 200 | 400 | 800 | 1600 |
| 密度/g•cm-3 | 3.21 | 0.81 | 0.20 | 0.11 |
①HCHO(g)+O2(g)→CO2(g)+H2O(l)+571kJ
②CH2COOH(g)+2O2(g)→2CO2(g)+2H2O(l)+926kJ
下列说法正确的是( )
| A. | 1mol HCHO(g)完全燃烧生成气态水时放热大于571kJ | |
| B. | 1mol CH3COOH(l)完全燃烧生成液态水时放热大于926kJ | |
| C. | 相同条件下,等质量的HCHO(g)与CH3COOH(g)所含能量相比,前者更高 | |
| D. | 相同条件下,等质量的HCHO(g)与CH3COOH(g)完全燃烧,后者放热更多 |
| A. | 2Al(s)+2NaOH(aq)+2H2O(l)═2NaAlO2(aq)+3H2(g);△H<0 | |
| B. | HNO3(aq)+KOH(aq)═KNO3(aq)+H2O(l);△H<0 | |
| C. | Ba(OH)2•8H2O(s)+2NH4Cl(s)═BaCl2(aq)+2NH3•H2O(aq)+8H2O(l);△H>0 | |
| D. | Na2O(s)+H2O(l)═2NaOH(aq);△H<0 |