��Ŀ����
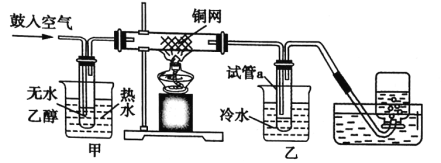
����Ŀ��ʵ����������������������Ҵ��Ʊ�1��2һ���������װ����ͼ��ʾ��

�й������б����£�
�Ҵ� | 1.2�������� | ���� | |
״̬ | ��ɫҺ�� | ��ɫҺ�� | ��ɫҺ�� |
�ܶ�/g/cm��3 | 0.79 | 2.2 | 0.71 |
�е�/�� | 78.5 | 132 | 34.6 |
�۵�/�� | ��130 | 9 | ��116 |
�밴Ҫ��ش��������⣺
��1��д��Aװ���еĻ�ѧ��Ӧ����ʽ_____��
��2��װ��C��ʢ������������Һ����������_____
��3���ڴ��Ʊ�ʵ���У�Ҫ������Ѹ�ٵذѷ�Ӧ�¶���ߵ�170�����ң�������ҪĿ����_____
��4���жϸ��Ʊ���Ӧ�Ѿ��������������_____��
��5����������������δ��Ӧ��Br2�������_____ϴ�ӳ�ȥ��������ȷѡ��ǰ����ĸ��
a ˮ b ���������� c �⻯����Һ d �Ҵ�
��6����Ӧ������Ӧ����ˮ��ȴװ��D������ҪĿ����_____�����ֲ��ܹ�����ȴ�����ñ�ˮ������ԭ����_____��
���𰸡�CH3CH2OH![]() CH2��CH2+H2O ��ȥ����CO2��SO2 ���ܴ��ڵ���Ҫ����Ӧ�У��Ҵ���Ũ����Ĵ�������140����ˮ�������ѣ� �۲�D����ɫ�Ƿ���ȫ��ȥ b ����������ӷ� ��Ʒ1��2һ����������۵㣨���̵㣩�ͣ�������ȴ�����̶���������
CH2��CH2+H2O ��ȥ����CO2��SO2 ���ܴ��ڵ���Ҫ����Ӧ�У��Ҵ���Ũ����Ĵ�������140����ˮ�������ѣ� �۲�D����ɫ�Ƿ���ȫ��ȥ b ����������ӷ� ��Ʒ1��2һ����������۵㣨���̵㣩�ͣ�������ȴ�����̶���������
��������
ʵ�����Ʊ�1��2-�������飺������ƿA�з�����Ӧ���Ҵ���Ũ����������·�����������ˮ��ȡ��ϩ���Ҵ���������ȥ��Ӧ����Ӧ����ʽΪ��CH3CH2OH![]() CH2=CH2��+H2O�����D�е����ܷ��������¹ʣ�A�в�������ϩ����ᵼ��װ��B��ѹǿ��������Һ�������������װ��B�г������ܿ��ж�װ���Ƿ������װ��B�����ã�Ũ���������ˮ�ԡ���ˮ�Ժ�ǿ�����ԣ��������Ҵ�����Ӧ����ʽΪ��CH3CH2OH+4H2SO4(Ũ)
CH2=CH2��+H2O�����D�е����ܷ��������¹ʣ�A�в�������ϩ����ᵼ��װ��B��ѹǿ��������Һ�������������װ��B�г������ܿ��ж�װ���Ƿ������װ��B�����ã�Ũ���������ˮ�ԡ���ˮ�Ժ�ǿ�����ԣ��������Ҵ�����Ӧ����ʽΪ��CH3CH2OH+4H2SO4(Ũ)![]() 4SO2��+CO2��+7H2O+C���������ɵ���������Ϊ������������̼��װ��C�з�����������Һ��������Ӧ��SO2+2NaOH=Na2SO3+H2O��CO2+2NaOH�TNa2CO3+H2O����ȥ�������壬��ϩ���в����ͼ�C=C˫������±�ص��ʷ����ӳɷ�Ӧ��D����ϩ����ӳ�����1��2-�������飬��ӦΪ��CH2=CH2+Br-Br��CH2Br-CH2Br���Ƶ�1��2-�������顣
4SO2��+CO2��+7H2O+C���������ɵ���������Ϊ������������̼��װ��C�з�����������Һ��������Ӧ��SO2+2NaOH=Na2SO3+H2O��CO2+2NaOH�TNa2CO3+H2O����ȥ�������壬��ϩ���в����ͼ�C=C˫������±�ص��ʷ����ӳɷ�Ӧ��D����ϩ����ӳ�����1��2-�������飬��ӦΪ��CH2=CH2+Br-Br��CH2Br-CH2Br���Ƶ�1��2-�������顣
��1��������������֪��װ��A�еĻ�ѧ��Ӧ����ʽΪ��CH3CH2OH![]() CH2=CH2��+H2O��
CH2=CH2��+H2O��
��2��������������֪��װ��C������Ϊ����ȥ����CO2��SO2��
��3���Ҵ���140��ʱ����ȡ����Ӧ�������ѣ�����������ϩ�������٣��ʴ�Ϊ�����ܴ��ڵ���Ҫ����Ӧ�У��Ҵ���Ũ����Ĵ�������140����ˮ�������ѣ�
��4����ϩ���巢���ӳɷ�Ӧ��ʹ��ˮ��ɫ������۲쵽D����ɫ��ȫ��ȥ��˵�����Ʊ���Ӧ�Ѿ��������ʴ�Ϊ���۲�D����ɫ�Ƿ���ȫ��ȥ��
��5������ˮ�е��ܽ�Ƚ�С���������ǿ�����ԣ���������ԭ�����ʣ��⼸������ֻ�����������ܱ�����������ѡb��
��6�����ж����ӷ������Է�Ӧ������Ӧ����ˮ��ȴװ��D����Ʒ1��2һ����������۵㣨���̵㣩�ͣ�������ȴ�����̶��������ܣ��ʴ�Ϊ����Ʒ1��2һ����������۵㣨���̵㣩�ͣ�������ȴ�����̶��������ܡ�

����Ŀ���±��и������ĸ�ʵ��װ�úͶ�Ӧ�IJ���ʵ����������a��b��c��dΪ�����缫���ɴ˿��ж����ֽ����Ļ��˳����( )
ʵ��װ�� |
|
|
|
|
����ʵ������ | a��������С b���������� | b�������ݲ��� c���ޱ仯 | d���ܽ� c�������ݲ��� | ������ָʾ�ڵ����� ������a������d�� |
A. d>a>b>cB. b>c>d>aC. a>b>c>dD. a>b>d>c
����Ŀ��ijͬѧ����ͼ��ʾʵ��װ��̽��ͭ��Ũ����ķ�Ӧ����¼ʵ���������������˵����ȷ����
�Թ� | �� | �� | �� | �� |
ʵ������ | ��Һ��Ϊ��ɫ���а�������ɫ������� | �д�����ɫ�������� | ��������ɫ�������� | Ʒ����Һ��ɫ |
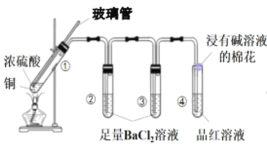
A.���а�ɫ������BaSO3
B.���п����в���Ũ����ӷ���
C.Ϊ��ȷ�����а�ɫ�����Ƿ�Ϊ����ͭ��������ȴ����Թ���ע��ˮ����
D.ʵ��ʱ������װ����ͨ������N2���ټ����Թܢ٣�ʵ������