��Ŀ����
����Ŀ����1.00molL-1NaOH��Һ����20.00mL1.00molL-1��һԪ��HA��Һ�У���û����Һ��pH���¶������NaOH��Һ����仯������ͼ��ʾ��
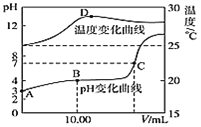
(1)��������ʱ20.00mL1.00molL-1��һԪ��HA�ĵ������=________
(2)ͼ��B����ʾ����Һ������������Ũ���ɴ�С��˳����_________
(3)����˵����ȷ����_______(����Ӧ���).
A.��ͼ�п�֪NaOH��HA��Ӧ��![]() H��0
H��0
B.ͼ��C������NaOH��Һ�����V=20.00mL
C.ͼ��C��ʱ��Һ��KW�Դ���1��10-14molL-1����Һ��c(H+)=1��10-7molL-1
D.ͼ��D�����Һ�¶����½�����Ҫԭ�������ɵ�NaAˮ������
(4)��������20mL0.1molL-1Na2CO3��Һ����μ���0.1molL-1HCl��Һ40mL����Һ�к�̼Ԫ�صĸ�����(CO2���ݳ�δ����)���ʵ�������(����)����ҺpH�仯�IJ��������ͼ��ʾ���ش��������⣺

����ͬһ��Һ�У�H2CO3��HCO3-��CO32-_________(������������������)�������棻
�ڵ�pH=7ʱ����Һ�к�̼Ԫ�ص���Ҫ��Ϊ_______����Һ�и������ӵ����ʵ���Ũ�ȵĴ�С��ϵΪ______________��
����֪��25��ʱ��CO32-ˮ�ⷴӦ��ƽ�ⳣ����ˮ�ⳣ��Kh=2��10-4molL-1������Һ��c(HCO3-)��c(CO32-)=2��1ʱ����Һ��pH=____
���𰸡�0.1% c(A-)> c(Na+)> c(H+)>c(OH-) C ���� HCO3-��H2CO3 c(Na+)> c(Cl-)> c(HCO3-)> c(H+)=c(OH-) 10
��������
��1�����ݵ���ȵı���ʽ��ͼ����20.00mL1.00molL-1��pH����������ȣ�
��2��B��ʱ����ΪHA��NaA�Ļ�����Һ��pH=4����Һ��ʾ���ԣ�˵��HA�ĵ���̶ȴ���A-��ˮ��̶ȣ����ݵ���غ�д����Һ�и�����Ũ�ȴ�С��
��3��A������кͷ�ӦΪ���ȷ�Ӧ���ʱ�С��0��
B������ͼ���֪��C����Һ��pH=7����������������HA��Ũ�ȵ����ʱ����ǿ�������Σ���Һ��ʾ���ԣ���V<20.00mL��
C���¶����ߣ�ˮ�����ӻ�������Һ��pH=7����������Ũ��Ϊ1��10-7molL-1��
D��D�����Һ�¶����½�����Ҫԭ������Һ��������Ũ�ȼ�С������ˮ�����ʵ�����С��
��4���ٸ���ͼ2��֪��pH=8ʱֻ��̼��������ӣ�pH����8ʱ����̼������Ӻ�̼������������ӣ�pHС��8ʱ����̼���̼��������ӣ���ͬһ��Һ�У�H2CO3��![]() ��
��![]() ���ܹ��棻
���ܹ��棻
��pH=7ʱ����Һ������Ϊ̼�����ơ��Ȼ��Ƽ�̼�ᣬ���ڵ�������ҪΪ��H2CO3��![]() ����Һ��ʾ���ԣ�c(H+)=c(OH-)�����ݵ���غ��ж���Һ�и�����Ũ�ȴ�С��ϵ��
����Һ��ʾ���ԣ�c(H+)=c(OH-)�����ݵ���غ��ж���Һ�и�����Ũ�ȴ�С��ϵ��
��ˮ�ⳣ��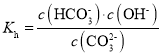 ������Һ��c(
������Һ��c(![]() )��c(
)��c(![]() )=2��1ʱ������ˮ�ⳣ������c(OH-)���ɸ���ˮ�����ӻ�KW����c(H+)������pH=-lgc(H+)���㡣
)=2��1ʱ������ˮ�ⳣ������c(OH-)���ɸ���ˮ�����ӻ�KW����c(H+)������pH=-lgc(H+)���㡣
��1������ͼ���֪��20.00mL1.00molL-1��pH=3����Һ��HA�������������Ũ��Ϊ0.001mol/L����HA�ĵ����Ϊ����=![]() ��100%=0.1%��
��100%=0.1%��
��2����ͼ���֪��B�����10mL��Ũ�ȵ�����������Һ����Ӧ������ΪHA��NaA�Ļ�����Һ��pH=4����Һ��ʾ���ԣ���c(H+)��c(OH-)��˵��HA�ĵ���̶ȴ���A-��ˮ��̶ȣ���c(A-)��c(Na+)��������Һ������Ũ�ȹ�ϵΪ��c(A-)��c(Na+)��c(H+)��c(OH-)��
��3��A������кͷ�ӦΪ���ȷ�Ӧ����ͼ�п�֪NaOH��HA��ӦΪ���ȷ�Ӧ����H��0����A����
B������ͼ���֪��C��ʱ��Һ��pH=7����������������HA��Ũ�ȵ����ʱ����ǿ�������Σ���Һ��ʾ���ԣ���V��20.00mL����B����
C��ˮ�ĵ���Ϊ���ȷ�Ӧ���¶����ߣ�ˮ�����ӻ�����C��ʱ��Һ��KW�Դ���1��10-14molL-1����Һ��pH=7ʱ����������Ũ��Ϊ1��10-7molL-1����C��ȷ��
D��D�����Һ��������Ũ����С��������Һ�¶����½�����Ҫԭ������Һ��������Ũ�ȼ�С������ˮ�����ʵ�����С���ų���������С���µģ���D����
�ʴ�Ϊ��C��
��4���ٽ��ͼ���֪����pH=8ʱֻ��̼��������Ӵ��ڣ�����Һ��pH����8ʱ�����ڵ�����Ϊ��![]() ��
��![]() ��pHС��8ʱ���ڵ�����Ϊ��H2C3��
��pHС��8ʱ���ڵ�����Ϊ��H2C3��![]() ��������ͬһ��Һ�У�H2CO3��
��������ͬһ��Һ�У�H2CO3��![]() ��
��![]() ���ܹ��棻
���ܹ��棻
�ڸ���ͼ���֪����pH=7ʱ����Һ������Ϊ̼�����ơ��Ȼ��Ƽ�̼�ᣬ��Һ�к�̼Ԫ�ص���Ҫ��Ϊ![]() ��H2CO3����ҺΪ���ԣ���c(H+)=c(OH-)�����ݵ���غ��֪��c(Na+)=c(Cl-)+c(
��H2CO3����ҺΪ���ԣ���c(H+)=c(OH-)�����ݵ���غ��֪��c(Na+)=c(Cl-)+c(![]() )��������Һ�и�����Ũ�ȹ�ϵΪ��c(Na+)��c(Cl-)��c(
)��������Һ�и�����Ũ�ȹ�ϵΪ��c(Na+)��c(Cl-)��c(![]() )��c(H+)=c(OH-)��
)��c(H+)=c(OH-)��
��![]() ˮ�ⷴӦ��ˮ�ⳣ��
ˮ�ⷴӦ��ˮ�ⳣ��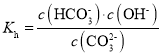 =2��10-4������Һ��c(
=2��10-4������Һ��c(![]() )��c(
)��c(![]() )=2��1ʱ��c(OH-)=10-4mol/L����ˮ�����ӻ�KW��֪��c(H+)=
)=2��1ʱ��c(OH-)=10-4mol/L����ˮ�����ӻ�KW��֪��c(H+)=![]() mol/L=10-10mol/L������pH=-lg10-10=10��
mol/L=10-10mol/L������pH=-lg10-10=10��

����Ŀ���±��и������ĸ�ʵ��װ�úͶ�Ӧ�IJ���ʵ����������a��b��c��dΪ�����缫���ɴ˿��ж����ֽ����Ļ��˳����( )
ʵ��װ�� |
|
|
|
|
����ʵ������ | a��������С b���������� | b�������ݲ��� c���ޱ仯 | d���ܽ� c�������ݲ��� | ������ָʾ�ڵ����� ������a������d�� |
A. d>a>b>cB. b>c>d>aC. a>b>c>dD. a>b>d>c