题目内容
【题目】经多年勘测,2018年11月23日省自然资源厅发布消息称在皖江地区发现特大铜矿床,具有重大实际意义。以黄铜矿(主要成分为CuFeS2,含有少量PbS、Al2O3、SiO2)为原料制取胆矾的流程如下图:

已知:常温下Ksp[Fe(OH)3]=8.0×10-38, Ksp[Al(OH)3]=3.0×10-33,Ksp[Cu(OH)2]=3.0×10-20。
(1)CuFeS2中硫元素的化合价为______,硫元素在周期表中的位置是______________。写出上述流程中生成亚硫酸铵的离子方程式:_______________________________。
(2)最适合的试剂A是________(写化学式)溶液,固体2的成份为PbSO4和_______。当试剂A的浓度为6mol·L-1时 ,“浸出”实验中,铜的浸出率结果如图所示。所采用的最佳实验条件(温度、时间)为_______________。

(3)最适合的试剂B是_______(填序号),最适合的试剂C是______(填序号),固体3的成份为_________________________。
a.Cl2 b.CuO c.酸性高锰酸钾溶液 d.NaOH e.H2O2 溶液 f.K2CO3
(4)操作1如在实验室中进行,用到的玻璃仪器有烧杯、玻璃棒和_______,操作2的步骤为________________过滤、洗涤。
(5)根据已知信息,请计算:当Fe3+完全沉淀时,溶液中Al3+理论最大浓度为______。(提示:当离子浓度≤1×10-5mol·L时,认为该离子沉淀完全)
【答案】-2 第三周期ⅥA族 SO2+CO32-=SO32-+CO2(SO2+H2O+2CO32-=SO32-+2HCO3-) H2SO4 SiO2 90℃、2.5小时 e b CuO、Fe(OH)3、Al(OH)3 漏斗 蒸发浓缩、冷却结晶 0.375mol/L
【解析】
(1)根据化合物的各元素化合价为0分析作答;硫元素原子序数为16,根据其原子结构示意图来判断元素周期表的位置;气体与碳酸铵反应生成亚硫酸铵,根据元素守恒可推出该气体为二氧化硫;
(2)根据实验目的,流程图中固体1主要有CuS2,想得到胆矾引入硫酸根离子,据此分析作答;工艺上,选出铜的浸出率最高的点即时最佳实验条件;
(3)溶液1中含铜离子、亚铁离子和铝离子,可加入环保氧化剂过氧化氢,将亚铁离子氧化成稳定的铁离子,便于沉淀,然后通过适当的试剂,且不引入其他杂质离子的前提下除掉铁离子与铝离子,得到纯净的硫酸铜溶液,据此分析作答;
(4)操作1为过滤过程,操作2为蒸发结晶,最终得到胆矾的过程,根据实验要求与基本操作分析所需实验仪器及操作步骤;
(5)先根据题意计算出Fe3+完全沉淀时的氢氧根离子浓度,再结合Ksp[Al(OH)3]=3.0×10-33,得出结论;
(1)CuFeS2分子中铜为+2价,铁为+2价,设硫元素化合价为x,则+2+2+2x = 0,解得x = -2价,硫元素的原子结构示意图为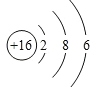 ,则其在周期表中的位置是第三周期ⅥA族;根据题意可知,上述流程中生成亚硫酸铵的离子方程式:SO2+CO32-=SO32-+CO2(SO2+H2O+2CO32-=SO32-+2HCO3-)。
,则其在周期表中的位置是第三周期ⅥA族;根据题意可知,上述流程中生成亚硫酸铵的离子方程式:SO2+CO32-=SO32-+CO2(SO2+H2O+2CO32-=SO32-+2HCO3-)。
故答案为:-2;第三周期ⅥA族;SO2+CO32-=SO32-+CO2(SO2+H2O+2CO32-=SO32-+2HCO3-);
(2)固体1加入试剂A后会生成硫酸铜溶液,则结合流程图可知,最适合的试剂A是硫酸,又SiO2不溶于水也不溶于硫酸,则固体2的成分中有SiO2;根据实验结果可以看出,在坐标系中,温度为90℃、浸出时间为2.5小时,铜的浸出率最高,此温度和浸出时间为最佳实验条件,
故答案为:H2SO4;SiO2;90℃、2.5小时
(3)根据实验流程图可知,需首先将亚铁离子氧化成铁离子,根据除杂原则,最好选环保氧化剂过氧化氢,a和c虽具有氧化性,但会引入氯离子与锰离子、钾离子等杂质,故a、c不选,e选;继续加入调节溶液酸碱性的试剂,使溶液中铁离子与铝离子沉淀下来,且不引入其他杂质离子,试剂C可选氧化铜,d氢氧化钠是强碱,过量的氢氧化钠会使已经沉淀的氢氧化铝溶解,不能达到除杂目的,f碳酸钾会引入新的杂质,故d、f不选,b选;
故答案选:e;b;
(4)操作1是将生成的沉淀过滤,所用仪器除烧杯、玻璃棒以外,还需要用到漏斗;操作2为硫酸铜溶液得到胆矾(五水合硫酸铜)的过程,则需要进行的操作步骤为:蒸发浓缩、冷却结晶、过滤、洗涤,
故答案为:漏斗;蒸发浓缩、冷却结晶;
(5)当Fe3+完全沉淀时,所需的氢氧根离子浓度c(OH-) = ![]() = 2×10-11 mol/L,则这时溶液中Al3+理论最大浓度
= 2×10-11 mol/L,则这时溶液中Al3+理论最大浓度![]() =
= ![]() = 0.375 mol/L,
= 0.375 mol/L,
故答案为:0.375 mol/L;

 阅读快车系列答案
阅读快车系列答案