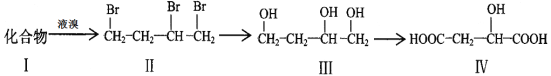
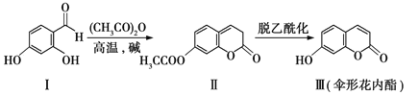
题目内容
【题目】伞形花内酯的一种制备方法如下: 下列说法不正确的是( )
A. Ⅰ、Ⅱ、Ⅲ均能发生水解反应
B. Ⅰ、Ⅱ、Ⅲ均能与溴水反应
C. 检验化合物Ⅱ中是否混有化合物Ⅰ,可用FeCl3溶液
D. 与化合物Ⅰ官能团种类、数目均相同且含有苯环的同分异构体有5种
【答案】A
【解析】
A项,化合物Ⅰ不能发生水解反应,符合题意;
B项,Ⅰ中含有酚羟基和醛基,可与Br2发生反应,Ⅱ中含有碳碳双键,可与Br2发生反应,Ⅲ中含有酚羟基和碳碳双键,能与Br2发生反应,则Ⅰ、Ⅱ、Ⅲ均能使溴水褪色,不符合题意;
C项,Ⅰ中含有酚羟基,Ⅱ中不含酚羟基,则可用FeCl3溶液检验Ⅱ中是否混有Ⅰ,不符合题意;
D项,相应的同分异构体为—CHO所插入的位置: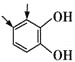 、
、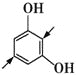 、
、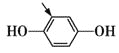 ,共5种,不符合题意。
,共5种,不符合题意。
故答案选A。

【题目】现有五种元素,其中A、B、C为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
A元素的核外电子数和电子层数相等 |
B元素原子的核外p电子数比s电子数少1 |
C原子第一至第四电离能如下: I1=738 kJ·mol-1,I2=1451 kJ·mol-1,I3=7733 kJ·mol-1,I4=10540 kJ·mol-1 |
F是前四周期中电负性最小的元素 |
G在周期表的第八列 |
(1)已知BA5为离子化合物,写出其电子式:________。
(2)B元素基态原子中能量最高的电子,其电子云在空间有______个方向,原子轨道呈____形。
(3)某同学根据上述信息,推断C基态原子的核外电子排布图为![]() ,该同学所画的电子排布图违背了___________________________________。
,该同学所画的电子排布图违背了___________________________________。
(4)G位于第____族____区,该元素的核外电子排布式为_____________________。该二价离子很容易被氧化成三价离子,从原子轨道理论解释原因________________________
(5)检验F元素的方法是___,请用原子结构的知识解释产生此现象的原因: ______。