题目内容
20.工业上可用黄铜矿(CuFeS2)冶炼铜,同时还可得到多种物质.工业冶炼铜的化学方程式是:8CuFeS2+2lO2 $\frac{\underline{\;高温\;}}{\;}$8Cu+4FeO+2Fe2O3+16SO2(1)CuFeS2中Fe的化合价为+2,反应中被还原的元素是氧元素和铜元素.
(2)用少量黄铜矿冶炼铜产生的炉渣(主要含Fe2O3、FeO、SiO2、Al2O3)模拟制铁红(Fe2O3),进行如下实验.
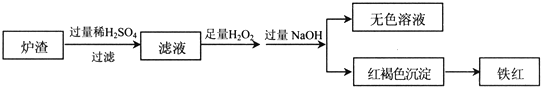
①滤液中的阳离子有Fe3+、Fe2+、H+、Al3+.
②为确认滤液中含Fe2+,下列实验方案和预期现象正确的是c(填序号).
| 实验方案 | 预期现象 | |
| a | 加NaOH溶液 | 产生白色沉淀,变灰绿再变红褐 |
| b | 先加KSCN溶液,再加氯水 | 先无明显现象,后变红 |
| C | 加酸性KMnO4溶液 | 紫色褪去 |
| d | 先加氯水,再加KSCN溶液 | 溶液先变黄,再变红 |
(3)冶炼铜过程中产生大量的SO2可用于制硫酸,尾气可用纯碱溶液吸收.已知用1L1mol/L的纯碱溶液吸收SO2,生成n(Na2SO3):n(NaHSO3)=1:2,则吸收的SO2物质的量是1.5mol.
分析 (1)CuFeS2中Fe的化合价为+2,根据反应8CuFeS2+2lO2$\frac{\underline{\;高温\;}}{\;}$8Cu+4FeO+2Fe2O3+16SO2中元素化合价变化判断反应中被还原的元素;
(2)①炉渣主要含Fe2O3、FeO、SiO2、Al2O3,然后根据与过量稀硫酸的反应判断滤液中的阳离子;
②根据亚铁离子检验还原性判断,注意滤液中含有铁离子,需要排除铁离子的干扰;
③亚铁离子能够与双氧水发生氧化还原反应生成铁离子、水,据此写出反应的离子方程式;
(3)碳酸钠与二氧化硫反应生成亚硫酸钠、亚硫酸氢钠,根据钠原子守恒及n(Na2SO3):n(NaHSO3)=1:2列式计算出二氧化碳的物质的量.
解答 解:(1)黄铜矿冶炼得到粗铜的一步反应为:8CuFeS2+21O2$\frac{\underline{\;高温\;}}{\;}$8Cu+4FeO+2Fe2O3+16SO2,若CuFeS2中的Fe的化合价为+2价,则铜的化合价为+2价,硫的化合价为-1价,氧气中氧元素的化合价为0价,产物中铜的化合价为0价,氧化亚铁中铁的化合价为+2价,氧元素为-2价,三氧化二铁中铁的元素化合价为+3价,氧元素为-2价,二氧化硫中硫元素的化合价为+4价,氧元素为-2价,根据氧化还原反应规律,化合价降低的发生还原反应,所以反应中被还原的元素是:Cu、O,
故答案为:铜元素;
(2)①炉渣中要含Fe2O3、FeO、SiO2、Al2O3和稀硫酸反应生成硫酸铁、硫酸亚铁和硫酸铝,所以滤液中含有的阳离子有:Fe3+、Fe2+、H+、Al3+,
故答案为:Al3+;
②a.由于溶液中含有Fe3+、Fe2+、H+、Al3+,所以a中加入氢氧化钠溶液后生成氢氧化铁红褐色沉淀会掩盖氢氧化亚铁沉淀,故a产物;
b.溶液中含有铁离子,因此加KSCN溶液显红色,无法据此检验铁离子,故b产物;
C.亚铁离子具有还原性,能使酸性高锰酸钾溶液褪色,故C正确;
d.溶液中含有铁离子,原溶液显黄色,无法据此检验亚铁离子,故d产物,
故答案为:c;
③双氧水具有氧化性,亚铁离子具有还原性,能氧化亚铁离子生成铁离子,反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(3)设SO2的物质的量是x,n(Na2SO3):n(NaHSO3)=1:2,根据S原子守恒可知:亚硫酸钠为$\frac{x}{3}$mol,亚硫酸氢钠为$\frac{2x}{3}$mol,
碳酸钠的物质的量为:1L×1mol/L=1mol,
根据钠原子守恒可知:$\frac{x}{3}$mol×2+$\frac{2x}{3}$mol=2mol,
解得:x=1.5mol,
故答案为:1.5.
点评 本题考查了物质的分离提纯方法及基本操作方法的综合应用,为中等难度的试题,试题贴近高考,综合性强,在注重对学生基础知识巩固和训练的同时,侧重对学生答题能力的培养和训练,意在培养学生分析、归纳、总结问题的能力,有利于培养学生的逻辑推理能力和抽象思维能力,题目难度较大.

| A. | 负极 | B. | 正极 | C. | 阴极 | D. | 阳极 |
| A. | 2倍 | B. | 1.5倍 | C. | 0.8倍 | D. | 0.5倍 |
| A. | 4 mol A+2 mol B | B. | 3 mol C+1 mol D+2mol A+1 mol B | ||
| C. | 3mol C+1 mol D+1 mol B | D. | 3 mol C+1 mol D |
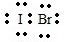 ,它是由极性共价键形成的极性分子.
,它是由极性共价键形成的极性分子.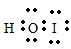 .
.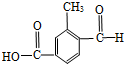 (1)具有复合官能团的复杂有机物中官能团具有各自的独立性,在不同条件下所发生的化学反应可分别从各官能团讨论.如图;具有两种官能团:
(1)具有复合官能团的复杂有机物中官能团具有各自的独立性,在不同条件下所发生的化学反应可分别从各官能团讨论.如图;具有两种官能团: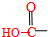 和
和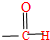 (填化学式),所以这个化合物看作羧酸类和醛类.
(填化学式),所以这个化合物看作羧酸类和醛类.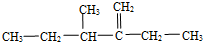 ,此烃的名称为3-甲基-2-乙基-1-戊烯
,此烃的名称为3-甲基-2-乙基-1-戊烯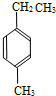 ,此烃名称为对甲基乙苯或4-甲基乙基苯
,此烃名称为对甲基乙苯或4-甲基乙基苯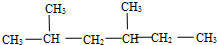 .
.
 .(不用写反应条件)
.(不用写反应条件)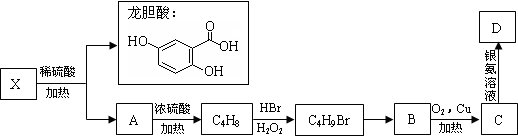
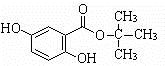 .
.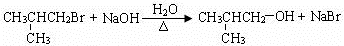 .(用结构简式表示)
.(用结构简式表示)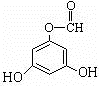 或
或 .
.