题目内容
1.室温时,将浓度和体积分别为c1、V1的NaOH溶液和c2、V2的CH3COOH溶液相混合,下列关于该混合溶液的叙述错误的是( )| A. | 在任何情况下都是c(Na+)+c(H+)=c(CH3COO-)+c(OH-) | |
| B. | 若pH>7,则一定是 c${\;}_{{1}_{\;}}$v1=c2v2 | |
| C. | 当pH=7时,若v1=v2,则一定是c2>c1 | |
| D. | 若v1=v2,c2=c1,则 c(CH3COO-)+c(CH3COOH)=c(Na+) |
分析 A.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
B.醋酸钠是强碱弱酸盐,其溶液呈碱性,如果混合溶液pH>7,溶液中溶质可能为醋酸钠、醋酸钠和少量醋酸或醋酸钠和氢氧化钠;
C.醋酸钠溶液呈碱性,pH=7时,若v1=v2,要使溶液呈中性,醋酸物质的量应该稍微大些;
D.任何电解质溶液中都存在物料守恒,根据物料守恒判断.
解答 解:A.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故A正确;
B.醋酸钠是强碱弱酸盐,其溶液呈碱性,如果混合溶液pH>7,溶液中溶质可能为醋酸钠、醋酸钠和少量醋酸或醋酸钠和氢氧化钠,所以若pH>7,则不一定是 c${\;}_{{1}_{\;}}$v1=c2v2,故B错误;
C.醋酸钠溶液呈碱性,要使溶液呈中性,醋酸物质的量应该稍微大些,pH=7时,若v1=v2,则一定是c2>c1,故C正确;
D.任何电解质溶液中都存在物料守恒,若v1=v2、c2=c1,二者物质的量相等,根据物料守恒得c(CH3COO-)+c(CH3COOH)=c(Na+),故D正确;
故选B.
点评 本题考查酸碱混合溶液定性判断及离子浓度大小比较,为高频考点,注意:任何电解质溶液中都存在电荷守恒和物料守恒,与电解质溶液酸碱性及浓度无关,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11.在密闭容器内放入5molH2和5molN2,在某温度下经过反应生成2molNH3,此时密闭容器内压强是反应前压强的( )
| A. | 2倍 | B. | 1.5倍 | C. | 0.8倍 | D. | 0.5倍 |
9.在一固定体积的密闭容器中加入2mol A和1mol B发生反应2A(g)+B(g)?3C(g)+D(g),达到平衡时C的浓度为w mol•L-1,若维持容器的体积和温度不变,按下列四种配比方案作为反应物,达平衡后,使C的浓度仍为w mol•L-1的配比是( )
| A. | 4 mol A+2 mol B | B. | 3 mol C+1 mol D+2mol A+1 mol B | ||
| C. | 3mol C+1 mol D+1 mol B | D. | 3 mol C+1 mol D |
16.实验室为监测空气中汞蒸汽的含量,往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为:CuI+Hg→Cu2HgI4+Cu (未配平),当有1molCuI参与反应时,转移的电子为( )
| A. | 0.25mol | B. | 0.5mol | C. | 1mol | D. | 2mol |
6.有4种碳骨架如下的烃,下列说法不正确的是( )

| A. | a和d互为同素异形体 | B. | b和c互为同系物 | ||
| C. | a和d都能发生加成反应 | D. | 只有b和c能发生取代反应 |
13.下列有关实验操作错误的是( )
| A. | 用药匙取用粉末状或小颗粒状固体 | |
| B. | 用胶头滴管滴加少量液体 | |
| C. | 给盛有2/3体积液体的试管加热 | |
| D. | 过滤时漏斗的下端管口要紧靠烧杯内壁 |

 .(不用写反应条件)
.(不用写反应条件)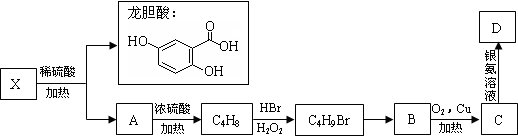
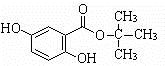 .
. .(用结构简式表示)
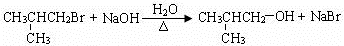
.(用结构简式表示)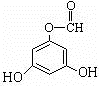 或
或 .
.
 Na2O2与水的反应实际是Na2O2+2H2O═2NaOH+H2O2,反应放出的热量使部分H2O2受热分解:2H2O2═2H2O+O2↑.为了测定某过氧化钠固体的纯度,今做如下实验:
Na2O2与水的反应实际是Na2O2+2H2O═2NaOH+H2O2,反应放出的热量使部分H2O2受热分解:2H2O2═2H2O+O2↑.为了测定某过氧化钠固体的纯度,今做如下实验: