题目内容
7.类推是学习化学的重要方法之一,但是类推经常会产生错误.下列类推正确的是( )| A. | 碳酸钙能与盐酸反应生成二氧化碳.类推:亚硫酸盐与所有的酸反应都能生成二氧化硫 | |
| B. | 浓硫酸与锌发生反应,先产生二氧化硫,后产生氢气.类推:浓硫酸与所有金属反应都能先产生二氧化硫,后产生氢气 | |
| C. | 浓盐酸、浓硝酸在空气中放置,溶液质量会减轻.类推:所有浓酸在空气中放置,溶液质量都会减轻 | |
| D. | 偏铝酸钠溶液能与碳酸氢钠溶液发生反应生成氢氧化铝.类推:向偏铝酸钠溶液中通入二氧化碳也能生成氢氧化铝 |
分析 A.亚硝酸盐与强氧化性酸反应生成硫酸盐,如亚硫酸钠与稀硝酸反应生成硫酸钠,不会生成二氧化硫;
B.浓硫酸与铁、铝会发生钝化现象,不会生成二氧化硫气体;
C.浓硫酸具有吸水性,则浓硫酸在空气中放置,其质量会增加;
D.氢氧化铝的酸性小于碳酸、碳酸氢根离子,则碳酸、碳酸氢根离子都与偏铝酸根离子反应生成氢氧化铝沉淀.
解答 解:A.碳酸钙能与盐酸反应生成二氧化碳,而亚硫酸盐与硝酸反应生成硫酸盐,不会生成二氧化硫气体,故A错误;
B.浓硫酸具有强氧化性,能够与锌发生反应先产生二氧化硫、后产生氢气,但是铝、铁能够与浓硫酸发生钝化现象,不能产生二氧化硫,故B错误;
C.浓盐酸能够挥发、浓硝酸易分解,则二者在空气中放置,溶液质量会减轻;而浓硫酸具有吸水性,若放置在空气中浓硫酸的质量会增加,故C错误;
D.偏铝酸钠溶液能与碳酸氢钠溶液发生反应生成氢氧化铝,由于碳酸的酸性大于碳酸氢根离子,则向偏铝酸钠溶液中通入二氧化碳也能生成氢氧化铝沉淀,该类推合理,故D正确;
故选D.
点评 本题考查了探究化学规律,题目难度中等,明确常见元素化合物性质为解答关键,注意掌握类推法的应用及判断方法,试题侧重考查学生的分析、理解能力及灵活应用能力.

练习册系列答案
相关题目
18.下列离子反应方程式书写正确的是( )
| A. | 氯气与水反应:Cl2+H2O═Cl-+2H++ClO- | |
| B. | 氨气通入醋酸溶液中:NH3+H+═NH4+ | |
| C. | 制备Fe(OH)3胶体:Fe3++3H2O $\frac{\underline{\;\;△\;\;}}{\;}$ Fe(OH)3(胶体)+3H+ | |
| D. | 碳酸氢钠溶液中加入过量石灰水:HCO3-+OH-═CO32-+H2O |
15.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 0.lmol甲烷含有的电子数为NA | |
| B. | lL 0.1mol/L Na2 CO3溶液中含有的CO32-数目为0.1NA | |
| C. | 1L pH=l的硫酸溶液中含有的H+数为0.2NA | |
| D. | 标准状况下,2.24L CO和CO2混合气体中含有的氧原子数为0.15NA |
19.亚铁是血红蛋白的重要组成成分,起着向人体组织传送O2的作用,如果缺铁就可能出现缺铁性贫血,但是摄人过量的铁也有害.下面是一种常见补铁药品说明书中的部分内容:该药品含Fe2+33%~36%,不溶于水但能溶于人体中的胃酸;与Vc(维生素C)同服可增加本品吸收.
(一)甲同学设计了以下实验检测该补铁药品中是否含有Fe2+并探究Vc的作用:
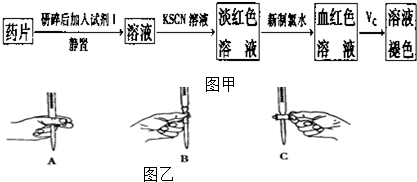
(二)乙同学采用在酸性条件下用高锰酸钾标准溶液滴定的方法测定该药品是否合格,反应原理为5Fe2++8H++MnO-4═5Fe3++Mn2++4H2O.准确称量上述药品10.00g,将其全部溶于试剂2中,配制成1000mL溶液,取出20.00mL,用 0.020mol/L的KMnO4溶液滴定,用去KMnO4溶液记录如下:
(1)乙同学在计算时取用KMnO4的体积数据为12.0mL;
(2)该药品含“铁”的含量是33.6%(填数值,不需计算过程)
(3)该实验中的试剂2与甲同学设计的实验中的试剂1都可以是C(填编号)
A.蒸馏水 B.稀盐酸 C.稀硫酸 D.稀硝酸
(4)本实验滴定过程中滴定管需用高锰酸钾标准溶液润洗,其操作方法是在酸式滴定管中加入1-2mLKMnO4溶液,将滴定管横过来并转动,让KMnO4溶液浸过滴定管内壁,从下面放掉浸洗液,重复操作2-3次.
操作滴定管的图示正确的是A(填编号)
(5)某同学做用标准NaOH溶液滴定HCl溶液测定其浓度,下列不当操作会导致实验结果偏高的是df
a.酸式滴定管在装酸液前未用待测盐酸溶液润洗.
b.开始实验时碱式滴定管尖嘴部分没有气泡,滴定结束生成气泡
c.锥形瓶内溶液颜色变化由无色变为粉红色,立即记下滴定管液面所在刻度.
d.盛待测溶液的锥形瓶滴定前用待测液液润洗.
e.锥形瓶在装盐酸后,又加了少量蒸馏水后滴定.
f.若用含少量NaCl的NaOH固体配制标准溶液用来滴定上述盐酸.
(一)甲同学设计了以下实验检测该补铁药品中是否含有Fe2+并探究Vc的作用:

(二)乙同学采用在酸性条件下用高锰酸钾标准溶液滴定的方法测定该药品是否合格,反应原理为5Fe2++8H++MnO-4═5Fe3++Mn2++4H2O.准确称量上述药品10.00g,将其全部溶于试剂2中,配制成1000mL溶液,取出20.00mL,用 0.020mol/L的KMnO4溶液滴定,用去KMnO4溶液记录如下:
| 待测液 体积(mL) | 标准液 | |||||
| 浓度(mol/L) | 滴定前 | 滴定后 | 体积(mL) | 平均值(mL) | ||
| 第一次 | 20.00 | 0.0200 | 0.00 | 14.30 | ||
| 第二次 | 0.20 | 12.22 | ||||
| 第三次 | 0.00 | 11.98 | ||||
(2)该药品含“铁”的含量是33.6%(填数值,不需计算过程)
(3)该实验中的试剂2与甲同学设计的实验中的试剂1都可以是C(填编号)
A.蒸馏水 B.稀盐酸 C.稀硫酸 D.稀硝酸
(4)本实验滴定过程中滴定管需用高锰酸钾标准溶液润洗,其操作方法是在酸式滴定管中加入1-2mLKMnO4溶液,将滴定管横过来并转动,让KMnO4溶液浸过滴定管内壁,从下面放掉浸洗液,重复操作2-3次.
操作滴定管的图示正确的是A(填编号)
(5)某同学做用标准NaOH溶液滴定HCl溶液测定其浓度,下列不当操作会导致实验结果偏高的是df
a.酸式滴定管在装酸液前未用待测盐酸溶液润洗.
b.开始实验时碱式滴定管尖嘴部分没有气泡,滴定结束生成气泡
c.锥形瓶内溶液颜色变化由无色变为粉红色,立即记下滴定管液面所在刻度.
d.盛待测溶液的锥形瓶滴定前用待测液液润洗.
e.锥形瓶在装盐酸后,又加了少量蒸馏水后滴定.
f.若用含少量NaCl的NaOH固体配制标准溶液用来滴定上述盐酸.
16.化学与生活、生产密切相关,下列说法正确的是( )
| A. | 煤的气化和液化都是化学变化 | |
| B. | BaSO4在医学上用作钡餐,Ba2+对人体无毒 | |
| C. | 铁、铝、铜在空气中长期放置表面都会生成氧化物 | |
| D. | 二氧化硫可广泛用于食品的增白 |
 (1)其中的铁、钙是指③(填序号);①分子 ②原子 ③元素
(1)其中的铁、钙是指③(填序号);①分子 ②原子 ③元素