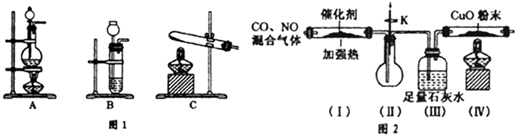
题目内容
2.配平方程式,并用双线桥表示电子转移1K2Cr2O7+14HCl═2KCl+2 CrCl3+3Cl2↑+7H2O.
分析 反应中重铬酸钾中的+6价铬化合价降为氯化铬中+3价,氯化氢中部分-1价的氯元素化合价升高为氯气中0价的氯,消耗1mol重铬酸价得到6mol电子,生成1mol氯气,则有2mol氯离子失去2mol电子,依据氧化还原反应得失电子守恒、原子个数守恒规律配制方程式.
解答 解:反应中重铬酸钾中的+6价铬化合价降为氯化铬中+3价,氯化氢中部分-1价的氯元素化合价升高为氯气中0价的氯,消耗1mol重铬酸价得到6mol电子,生成1mol氯气,则有2mol氯离子失去2mol电子,要使氧化剂得到电子总数等于还原剂失去电子总数,则二者最小公倍数为6,则重铬酸钾系数为1,氯气系数为3,依据钾原子个数守恒,氯化钾系数为2,依据铬原子个数守恒,氯化铬系数为2,依据氯原子个数守恒,氯化氢系数为14,依据氢原子个数守恒,水分子系数为7,化学方程式:1K2Cr2O7+14HCl═2KCl+2 CrCl3+3Cl2↑+7H2O;
故答案为:1、14、2、2、3、7.
点评 本题考查了氧化还原方程式书写,准确判断各元素化合价在反应中变化情况,熟悉氧化还原反应中得失电子守恒规律、原子个数守恒规律是解题关键,题目难度不大.

练习册系列答案
相关题目
14.对于BaSO4,不能将其划归( )类.
| A. | 钡盐 | B. | 硫酸盐 | C. | 难溶性盐 | D. | 可溶性盐 |
13.下列关于如图所示实验的说法正确的是( )
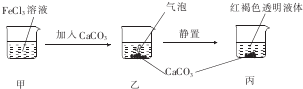

| A. | 甲、丙两液体均可产生丁达尔现象 | |
| B. | 乙中产生的气泡能使BaCl2溶液变浑浊 | |
| C. | 若忽略溶液体积的变化,则烧杯中c(Cl-)不变 | |
| D. | 若将CaC03换成CaS04,也可得到相同的实验现象 |
17. Na2S2O3俗称大苏打(海波)是重要的化工原料.用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3.已知10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60,.0g和212g.常温下,从溶液中析出的晶体是Na2S2O3•5H2O.
Na2S2O3俗称大苏打(海波)是重要的化工原料.用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3.已知10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60,.0g和212g.常温下,从溶液中析出的晶体是Na2S2O3•5H2O.
现实验室欲制取Na2S2O3•5H2O晶体(Na2S2O3•5H2O的分子量为248)步骤如下:
①称取12.6g Na2SO3于烧杯中,溶于80.0mL水.
②另取4.0g硫粉,用少许乙醇润湿后,加到上述溶液中.
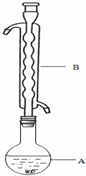
③(如图所示,部分装置略去),水浴加热,微沸,反应约1小时后过滤.
④滤液在经过蒸发浓缩、冷却结晶后析出Na2S2O3•5H2O晶体.
⑤进行减压过滤并干燥.
(1)仪器B的名称是冷凝管或冷凝器.其作用是冷凝回流.加入的硫粉用乙醇润湿的目的是增加反应物的接触面积,加快反应速率.
(2)滤液中除Na2S2O3和可能未反应完全的Na2SO3外,最可能存在的无机杂质是Na2SO4.如果滤液中该杂质的含量不很低,其检测的方法是:取出少许滤液置于试管,加稀盐酸至溶液呈酸性后,过滤得出S,再往滤液中加BaCl2溶液,如有白色沉淀即可证明含有Na2SO4,反之不含.
(3)为了测产品的纯度,称取7.40g 产品,配制成250mL溶液,用移液管移取25.00mL于锥形瓶中,滴加淀粉溶液作指示剂,再用浓度为0.0500mol/L 的碘水,用酸式(填“酸式”或“碱式”)滴定管来滴定(2S2O32-+I2=S4O62-+2I-),滴定结果如下:
则所得产品的纯度为103.2%,你认为影响纯度的主要原因是(不考虑操作引起误差)含有的Na2SO3也会和I2发生反应,从而影响纯度.
 Na2S2O3俗称大苏打(海波)是重要的化工原料.用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3.已知10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60,.0g和212g.常温下,从溶液中析出的晶体是Na2S2O3•5H2O.
Na2S2O3俗称大苏打(海波)是重要的化工原料.用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3.已知10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60,.0g和212g.常温下,从溶液中析出的晶体是Na2S2O3•5H2O.现实验室欲制取Na2S2O3•5H2O晶体(Na2S2O3•5H2O的分子量为248)步骤如下:
①称取12.6g Na2SO3于烧杯中,溶于80.0mL水.
②另取4.0g硫粉,用少许乙醇润湿后,加到上述溶液中.
③(如图所示,部分装置略去),水浴加热,微沸,反应约1小时后过滤.
④滤液在经过蒸发浓缩、冷却结晶后析出Na2S2O3•5H2O晶体.
⑤进行减压过滤并干燥.
(1)仪器B的名称是冷凝管或冷凝器.其作用是冷凝回流.加入的硫粉用乙醇润湿的目的是增加反应物的接触面积,加快反应速率.
(2)滤液中除Na2S2O3和可能未反应完全的Na2SO3外,最可能存在的无机杂质是Na2SO4.如果滤液中该杂质的含量不很低,其检测的方法是:取出少许滤液置于试管,加稀盐酸至溶液呈酸性后,过滤得出S,再往滤液中加BaCl2溶液,如有白色沉淀即可证明含有Na2SO4,反之不含.
(3)为了测产品的纯度,称取7.40g 产品,配制成250mL溶液,用移液管移取25.00mL于锥形瓶中,滴加淀粉溶液作指示剂,再用浓度为0.0500mol/L 的碘水,用酸式(填“酸式”或“碱式”)滴定管来滴定(2S2O32-+I2=S4O62-+2I-),滴定结果如下:
| 滴定次数 | 滴定前读数(mL) | 滴定滴定后读数(mL) |
| 第一次 | 0.30 | 31.12 |
| 第二次 | 0.36 | 31.56 |
| 第三次 | 1.10 | 31.88 |
7.类推是学习化学的重要方法之一,但是类推经常会产生错误.下列类推正确的是( )
| A. | 碳酸钙能与盐酸反应生成二氧化碳.类推:亚硫酸盐与所有的酸反应都能生成二氧化硫 | |
| B. | 浓硫酸与锌发生反应,先产生二氧化硫,后产生氢气.类推:浓硫酸与所有金属反应都能先产生二氧化硫,后产生氢气 | |
| C. | 浓盐酸、浓硝酸在空气中放置,溶液质量会减轻.类推:所有浓酸在空气中放置,溶液质量都会减轻 | |
| D. | 偏铝酸钠溶液能与碳酸氢钠溶液发生反应生成氢氧化铝.类推:向偏铝酸钠溶液中通入二氧化碳也能生成氢氧化铝 |
14.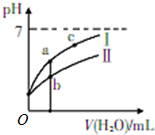 已知如表为25℃时某些弱酸的电离平衡常数;如图表示常温时,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.
已知如表为25℃时某些弱酸的电离平衡常数;如图表示常温时,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.
(1)图象中,曲线Ⅰ表示的酸是CH3COOH(填化学式);
(2)a、b、c三点中,水的电离程度由大到小的顺序是c>a>b(用编号表示).
(3)25℃时,NaClO溶液的水解平衡常数Kh=3.3×10-7molL-1.
(4)25℃时,NaHCO3溶液存在水解平衡,写出其水解的离子方程式HCO3-+H2O≒H2CO3+OH-
(5)0.1mol/L Na2CO3溶液中c(OH)-c(H+)=c(HCO3-)+2c(H2CO3).(用含c(HCO${\;}_{3}^{-}$),c(H2CO3)的关系式表示).
 已知如表为25℃时某些弱酸的电离平衡常数;如图表示常温时,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.
已知如表为25℃时某些弱酸的电离平衡常数;如图表示常温时,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.| CH2COOH | HClO | H2CO2 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7Ka2=4.7×10-11 |
(2)a、b、c三点中,水的电离程度由大到小的顺序是c>a>b(用编号表示).
(3)25℃时,NaClO溶液的水解平衡常数Kh=3.3×10-7molL-1.
(4)25℃时,NaHCO3溶液存在水解平衡,写出其水解的离子方程式HCO3-+H2O≒H2CO3+OH-
(5)0.1mol/L Na2CO3溶液中c(OH)-c(H+)=c(HCO3-)+2c(H2CO3).(用含c(HCO${\;}_{3}^{-}$),c(H2CO3)的关系式表示).