题目内容
15.NA表示阿伏加德罗常数的值,下列说法正确的是( )| A. | 0.lmol甲烷含有的电子数为NA | |
| B. | lL 0.1mol/L Na2 CO3溶液中含有的CO32-数目为0.1NA | |
| C. | 1L pH=l的硫酸溶液中含有的H+数为0.2NA | |
| D. | 标准状况下,2.24L CO和CO2混合气体中含有的氧原子数为0.15NA |
分析 A、甲烷为10电子分子;
B、CO32-是弱酸根,在溶液中能水解;
C、pH=1的硫酸溶液中的氢离子浓度为0.1mol/L;
D、标况下2.24LCO和二氧化碳的物质的量为0.1mol,而CO中含1个氧原子,而二氧化碳中含2个氧原子.
解答 解:A、甲烷为10电子分子,故0.1mol甲烷中含1mol电子即NA个,故A正确;
B、CO32-是弱酸根,在溶液中能水解,故溶液中的碳酸根的个数小于0.1NA个,故B错误;
C、pH=1的硫酸溶液中的氢离子浓度为0.1mol/L,故溶液中的氢离子的物质的量为n=CV=0.1mol/L×1L=0.1mol,个数为0.1NA个,故C错误;
D、标况下2.24LCO和二氧化碳的物质的量为0.1mol,而CO中含1个氧原子,而二氧化碳中含2个氧原子,故0.1mol混合物中含有的氧原子的个数介于0.1NA到0.2NA之间,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
6.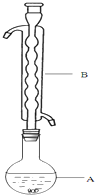 Na2S2O3俗称大苏打(海波)是重要的化工原料.用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3.已知10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60,.0g和212g.常温下,从溶液中析出的晶体是Na2S2O3•5H2O.现实验室欲制取Na2S2O3•5H2O晶体(Na2S2O3•5H2O的分子量为248)步骤如下:
Na2S2O3俗称大苏打(海波)是重要的化工原料.用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3.已知10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60,.0g和212g.常温下,从溶液中析出的晶体是Na2S2O3•5H2O.现实验室欲制取Na2S2O3•5H2O晶体(Na2S2O3•5H2O的分子量为248)步骤如下:
①称取12.6g Na2SO3于烧杯中,溶于80.0mL水.
②另取4.0g硫粉,用少许乙醇润湿后,加到上述溶液中.
③(如图所示,部分装置略去),水浴加热,微沸,反应约1小时后过滤.
④滤液在经过蒸发浓缩、冷却结晶后析出Na2S2O3•5H2O晶体.
⑤进行减压过滤并干燥.
(1)仪器B的名称是球形冷凝管.其作用是冷凝回流.加入的硫粉用乙醇润湿的目的是增加反应物接触面积,提高反应速率.
(2)步骤④应采取的操作是蒸发浓缩、冷却结晶.
(3)滤液中除Na2S2O3和可能未反应完全的Na2SO3外,最可能存在的无机杂质是Na2SO4.如果滤液中该杂质的含量不很低,其检测的方法是:取出少许溶液,加稀盐酸至酸性,静置后,取上层清液或过滤除去S,再加BaCl2溶液,若出现浑浊则含Na2SO4,反之不含.
(4)为了测产品的纯度,称取7.40g 产品,配制成250mL溶液,用移液管移取25.00mL于锥形瓶中,滴加淀粉溶液作指示剂,再用浓度为0.0500mol/L 的碘水,用酸式(填“酸式”或“碱式”)滴定管来滴定(2S2O32-+I2=S4O62-+2I-),滴定结果如下:
则所得产品的纯度为103.2%,你认为影响纯度的主要原因是(不考虑操作引起误差)含有的Na2SO3也会和I2发生反应,从而影响纯度.
 Na2S2O3俗称大苏打(海波)是重要的化工原料.用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3.已知10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60,.0g和212g.常温下,从溶液中析出的晶体是Na2S2O3•5H2O.现实验室欲制取Na2S2O3•5H2O晶体(Na2S2O3•5H2O的分子量为248)步骤如下:
Na2S2O3俗称大苏打(海波)是重要的化工原料.用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3.已知10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60,.0g和212g.常温下,从溶液中析出的晶体是Na2S2O3•5H2O.现实验室欲制取Na2S2O3•5H2O晶体(Na2S2O3•5H2O的分子量为248)步骤如下:①称取12.6g Na2SO3于烧杯中,溶于80.0mL水.
②另取4.0g硫粉,用少许乙醇润湿后,加到上述溶液中.
③(如图所示,部分装置略去),水浴加热,微沸,反应约1小时后过滤.
④滤液在经过蒸发浓缩、冷却结晶后析出Na2S2O3•5H2O晶体.
⑤进行减压过滤并干燥.
(1)仪器B的名称是球形冷凝管.其作用是冷凝回流.加入的硫粉用乙醇润湿的目的是增加反应物接触面积,提高反应速率.
(2)步骤④应采取的操作是蒸发浓缩、冷却结晶.
(3)滤液中除Na2S2O3和可能未反应完全的Na2SO3外,最可能存在的无机杂质是Na2SO4.如果滤液中该杂质的含量不很低,其检测的方法是:取出少许溶液,加稀盐酸至酸性,静置后,取上层清液或过滤除去S,再加BaCl2溶液,若出现浑浊则含Na2SO4,反之不含.
(4)为了测产品的纯度,称取7.40g 产品,配制成250mL溶液,用移液管移取25.00mL于锥形瓶中,滴加淀粉溶液作指示剂,再用浓度为0.0500mol/L 的碘水,用酸式(填“酸式”或“碱式”)滴定管来滴定(2S2O32-+I2=S4O62-+2I-),滴定结果如下:
| 滴定次数 | 滴定前读数(mL) | 滴定滴定后读数(mL) |
| 第一次 | 0.30 | 31.12 |
| 第二次 | 0.36 | 31.56 |
| 第三次 | 1.10 | 31.88 |
3. 一定条件下存在反应C(s)+H2O(g)═CO(g)+H2(g):向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示.下列说法正确的是( )
一定条件下存在反应C(s)+H2O(g)═CO(g)+H2(g):向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示.下列说法正确的是( )
 一定条件下存在反应C(s)+H2O(g)═CO(g)+H2(g):向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示.下列说法正确的是( )
一定条件下存在反应C(s)+H2O(g)═CO(g)+H2(g):向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示.下列说法正确的是( )| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5L | 0.5L | V |
| 温度 | T1℃ | T2℃ | T1℃ |
| 起始量 | 2molC 1molH2O | 1molCO 1molH2 | 4molC 2molH2O |
| A. | 甲容器中,反应在前15min的平均速率v(H2)=0.1 mol•L-1•min-1 | |
| B. | 丙容器的体积V>0.5L | |
| C. | 当温度为T1℃时,反应的平衡常数K=4.5 | |
| D. | 乙容器中,若平衡时n(H2O)=0.4 mol,则T1<T2 |
20.检验某未知溶液中是否含有氯离子(Cl-),正确的操作是( )
| A. | 向未知溶液中加入AgNO3溶液,有白色沉淀产生 | |
| B. | 向未知溶液中加入AgNO3溶液,有白色沉淀产生,加入盐酸,沉淀不消失 | |
| C. | 向未知溶液中加入稀硝酸酸化后,再加入AgNO3溶液,有白色沉淀产生 | |
| D. | 向未知溶液中加入稀盐酸酸化后,再加入AgNO3溶液,有白色沉淀产生 |
7.类推是学习化学的重要方法之一,但是类推经常会产生错误.下列类推正确的是( )
| A. | 碳酸钙能与盐酸反应生成二氧化碳.类推:亚硫酸盐与所有的酸反应都能生成二氧化硫 | |
| B. | 浓硫酸与锌发生反应,先产生二氧化硫,后产生氢气.类推:浓硫酸与所有金属反应都能先产生二氧化硫,后产生氢气 | |
| C. | 浓盐酸、浓硝酸在空气中放置,溶液质量会减轻.类推:所有浓酸在空气中放置,溶液质量都会减轻 | |
| D. | 偏铝酸钠溶液能与碳酸氢钠溶液发生反应生成氢氧化铝.类推:向偏铝酸钠溶液中通入二氧化碳也能生成氢氧化铝 |
5.在标准状况下,若V升甲烷(CH4)中含有的氢原子数为n,则阿伏加德罗常数可表示为( )
| A. | $\frac{Vn}{22.4}$ | B. | $\frac{22.4n}{V}$ | C. | $\frac{5.6n}{V}$ | D. | $\frac{Vn}{5.6}$ |