题目内容
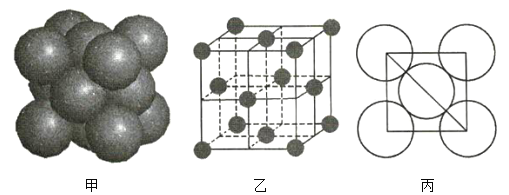
【题目】(1)图甲为晶体的二维平面示意图,所表示物质的化学式可能为AX2的是______(填“a”或“b”)。
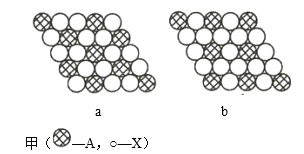
(2)图乙为金属铜的晶胞示意图,请回答下列问题。
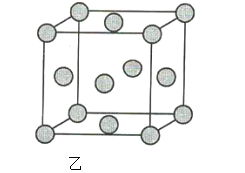
①该晶胞实际含有的铜原子数是______。
②该晶胞称为______(填序号)。
A.六方晶胞 B.体心立方晶胞 C.面心立方晶胞 D.简单立方晶胞
③该晶胞的边长为a cm, Cu的摩尔质量为64g·mol-1,金属铜的密度为pg·cm-3,则阿伏加德罗常数为___(用含a、p的代数式表示)。
【答案】a 4 C ![]()
【解析】
(1)由图中直接相邻的原子数可求得a、b中A、X个数之比分别为1:2、1:3,则其所代表物质的化学式分别可能为AX2,、AX3。
(2)①采用切割法,则该晶胞实际含有的铜原子数为8×1/8+6×1/2=4。②该晶胞为面心立方晶胞。③由![]() ,解得
,解得![]() 。
。
(1)a中每个白色小球被3个黑色小球共用,每个黑色小球被6个白色小球共用,则黑色小球和白色小球个数之比为![]() ,表示的化学式为AX2,b中每个白色小球被2个黑色小球共用,每个黑色小球被6个白色小球共用,则黑色小球和白色小球个数之比为
,表示的化学式为AX2,b中每个白色小球被2个黑色小球共用,每个黑色小球被6个白色小球共用,则黑色小球和白色小球个数之比为![]() ,表示的化学式为AX3,故答案为:a;
,表示的化学式为AX3,故答案为:a;
(2)①根据图乙可知,该晶胞中含有6个半球,8个![]() 球,则该晶胞中Cu原子的个数为
球,则该晶胞中Cu原子的个数为![]() ,故答案为:4;
,故答案为:4;
②该晶胞属于面心立方晶胞,故答案为:C;
③晶胞体积为a3 cm3,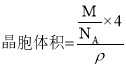 ,则
,则![]() ,故答案为:
,故答案为:![]() 。
。

 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案【题目】下面是A~G七种元素的电子排布:
元素 电子排布 电子层 | A | B | C | D | E | F | G |
K | 1 | 2 | 2 | 2 | 2 | 2 | 2 |
L | 4 | 5 | 6 | 8 | 8 | 8 | |
M | 1 | 3 | 7 |
试根据由上述元素构成的物质的化学式回答下列问题。
(1)写出一种常见的由非极性键形成的双原子分子:____________________。
(2)写出一种由极性键形成的双原子分子:____________________。
(3)写出一种由极性键形成的三原子分子:____________________。
(4)写出一种由三种元素形成的既含离子键又含共价键的化合物:__________,其电子式为____________________。
(5)写出一种既含离子键又含非极性键的化合物:__________,其电子式为__________。
【题目】研究NO的性质对建设美丽家乡,打造宜居环境具有重要意义。
(1)自然界在闪电时,生成NO的反应方程式为__________________。
(2)T℃时在容积为2L的恒容密闭容器中,充入NO和O2发生反应:2NO(g)+O2(g)2NO2(g),不同时刻测得容器中n(NO)、n(O2)如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 1 | 0.6 | 0.4 | 0.2 | 0.2 | 0.2 |
n(O2)/mol | 0.6 | 0.4 | 0.3 | 0.2 | 0.2 | 0.2 |
①在T℃下,0~2s时,该反应的平均反应速率![]() =________;
=________;
②该温度下反应的平衡常数K=________,在T℃下,能提高NO的平衡转化率的措施有_______、________。
(3)已知NO和O2反应的历程如图,回答下列问题:
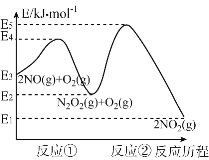
①写出其中反应①的热化学方程式也(△H用含物理量E的等式表示):________。
②试分析上述基元反应中,反应①和反应②的速率较小的是_____(选填“反应①”或“反应②”);已知反应①会快速建立平衡状态,反应②可近似认为不影响反应①的平衡。对该反应体系升高温度,发现总反应速率变慢,其原因可能是____________。