题目内容
【题目】短周期元素a、b、c、d的原子序数依次增大,c和d位于同主族且原子序数相差8;基态a原子核外有3个能级上容纳电子且每个能级上电子数相等,c原子s能级电子总数与p能级电子数相等,基态e原子的M层上有2个未成对电子且无空轨道。
(1)在a、b、c中,第一电离能由大到小排序为 (用元素符号表示);基态e原子的价层电子排布式为 。
(2)配合物e(ac)4在常温下呈液态,易溶于四氯化碳、苯等有机溶剂。固态e(ac)4的晶体类型是 。已知(dab)2分子中含非极性键,分子中每个原子最外层都达到8个电子稳定结构,1mol(dab)2分子含σ键的数目为 。
(3)写出一种与dab-互为等电子体的分子 (填化学式)。ac32-的中心原子杂化类型为 ;dc32-的空间构型为 。
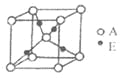
(4)ec晶胞结构如图所示,其晶胞参数为a pm,列式计算该晶胞的密度为 g·cm-3(不必计算出结果,阿伏伽德罗常数的值为NA),晶胞中c粒子的配位数为 。

(5)人工合成的ec晶胞存在缺陷,即阳离子有+3、+2价两种。某人工合成的晶体样品组成为e0.96c,则该晶体中+3价、+2价两种离子的个数之比为 。
【答案】(1)N>O>C 3d84s2;
(2)分子晶体;5×6.02×1023;
(3)CO2(或N2O);sp2;三角锥型;
(4)![]() ;6;
;6;
(5)1:11;
【解析】
试题分析:短周期元素a、b、c、d的原子序数依次增大,基态a原子核外有3个能级上容纳电子且每个能级上电子数相等,a为C元素;c原子s能级电子总数与p能级电子数相等,c为O元素;则b为N元素;c和d位于同主族且原子序数相差8;则d为S元素;基态e原子的M层上有2个未成对电子且无空轨道,电子排布为3d84s2,为Ni元素。
(1)N原子的2p为半充满状态,较为稳定,第一电离能由大到小排序为N>O>C,基态e原子的价层电子排布式为3d84s2,故答案为:N>O>C;3d84s2;
(2)配合物Ni(CO)4在常温下呈液态,易溶于四氯化碳、苯等有机溶剂,固态时构成分子晶体。已知(SCN)2分子中含非极性键,分子中每个原子最外层都达到8个电子稳定结构,(SCN)2的结构为N≡C-S-S-C≡N,1mol(SCN)2分子含σ键的数目为5×6.02×1023,故答案为:分子晶体;5×6.02×1023;
(3)与SCN-互为等电子体的分子有CO2(或N2O),CO32-中C的价层电子对数=3+![]() (4+2-2×3)=3,杂化类型为sp2,SO32-中S的价层电子对数=3+
(4+2-2×3)=3,杂化类型为sp2,SO32-中S的价层电子对数=3+![]() (6+2-2×3)=4,杂化类型为sp3,空间构型为三角锥型,故答案为:CO2(或N2O);sp2;三角锥型;
(6+2-2×3)=4,杂化类型为sp3,空间构型为三角锥型,故答案为:CO2(或N2O);sp2;三角锥型;
(4)晶胞中O2-离子数目为1+12×![]() =4,故晶胞质量为4×
=4,故晶胞质量为4×![]() g,晶胞体积为(a×10-10cm)3,故晶胞密度为
g,晶胞体积为(a×10-10cm)3,故晶胞密度为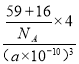 g/cm3=
g/cm3=![]() g/cm3,Ni2+离子位于晶胞顶点及面心,晶胞中Ni2+数目x=8×
g/cm3,Ni2+离子位于晶胞顶点及面心,晶胞中Ni2+数目x=8×![]() +6×
+6×![]() =4,以顶点Ni2+离子研究,与之最近的O2-离子位于棱中间且关于Ni2+离子对称,故Ni2+的配位数y=6,故答案为:
=4,以顶点Ni2+离子研究,与之最近的O2-离子位于棱中间且关于Ni2+离子对称,故Ni2+的配位数y=6,故答案为:![]() ;6;
;6;
(5)设1mol Ni0.96O中含Ni3+xmol,Ni2+为(0.96-x)mol,晶体呈电中性,可知3x+2×(0.96-x)=2×1,解得x=0.08mol,故Ni2+为(0.96-x)mol=0.88mol,Ni3+、Ni2+的数目之比=0.08:0.88=1:11,故答案为:1:11。

 名师点拨卷系列答案
名师点拨卷系列答案【题目】如图依次为气体制得、除杂并检验其性质的装置(加热及夹持仪器省略)。下列设计不能达到目的的是( )

选项 | 气体 | 装置中药品 | ||
a | b | c | ||
A | C2H2 | 饱和食盐水+电石 | CuS04溶液 | 溴水 |
B | CO2 | 稀盐酸+石灰石 | 饱和NaHC03溶液 | 苯酚蚋溶液 |
C | C2H4 | 溴乙烷+ NaOH乙醇溶液 | 水 | K2z Cr207,酸性溶液 |
D | SO2 | 碳+浓硫酸 | 新制氯水 | 品红溶液 |