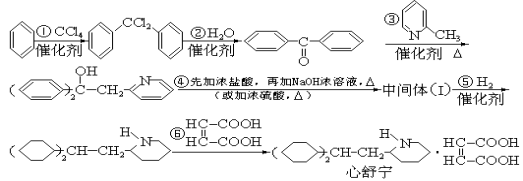
题目内容
【题目】(2016·银川模拟)工业上通常以铝土矿(主要成分为Al2O3,含有少量Fe2O3、SiO2等杂质)为原料制备无水氯化铝:2Al2O3+6Cl2![]() 4AlCl3+3O2。
4AlCl3+3O2。
(1)为促进反应的进行,实际生产中需加入焦炭,其原因是_____________________。
(2)加入焦炭后的化学反应可表示为Al2O3+C+Cl2AlCl3+X↑,设计实验确定气体X的__________________。
(3)在提纯AlCl3粗产品时,需加入少量铝粉,可使熔点较低的FeCl3转化为熔点较高的FeCl2,从而避免在AlCl3中混入铁的氯化物。该反应的化学方程式为________________________。
(4)以铝土矿为原料可以通过以下途径提纯氧化铝:

①写出滤液甲中溶质的化学式:___________________________。
②写出滤液乙中加入过量氨水得到Al(OH)3的离子方程式:__________________________。
③要进一步获得金属铝,工业上采用的冶炼方法是_______________,
有关反应的化学方程式为________________________。
【答案】(1)加入焦炭消耗反应生成的氧气,使平衡向正反应方向移动;(2)将气体通入澄清石灰水中,若澄清石灰水变浑浊,则说明生成的气体X为CO2;(3)Al+3FeCl3AlCl3+3FeCl2;(4)①NaAlO2、Na2SiO3;②Al3++3NH3·H2O===Al(OH)3↓+3NH4+;③电解法 2Al2O3(熔融)4Al+3O2↑。
【解析】
试题分析:(1)焦炭和氧气反应,减少生成物浓度,促使反应向正反应方向进行;(2)根据反应方程式中元素守恒和原子个数守恒,则X含有C和O,可能是CO,也可能是CO2,因此有将气体通入澄清石灰水中,若澄清石灰水变浑浊,则说明生成的气体X为CO2;(3)根据信息,加入铝后,FeCl3→FeCl2,发生氧化还原反应,因此反应方程式为:Al+3FeCl3![]() AlCl3+3FeCl2;(4)①Al2O3表现两性,Fe2O3是碱性氧化物,SiO2是酸性氧化物,因此有Al2O3+2NaOH=2NaAlO2+H2O,SiO2+2NaOH=Na2SiO3+H2O,Fe2O3不反应,因此滤液甲中溶质是NaAlO2、Na2SiO3、NaOH;②滤液甲中加入过量的稀盐酸,发生主要反应是AlO2-+4H+=Al3++2H2O,SiO32-+2H+=H2SiO3↓,滤液乙的主要成分是AlCl3,然后加入过量氨水,发生的离子反应式Al3++3NH3·H2O=Al(OH)3↓+3NH4+;③铝是活泼金属,工业上一般采用电解熔融状态的氧化铝冶炼铝单质,2Al2O3(熔融)
AlCl3+3FeCl2;(4)①Al2O3表现两性,Fe2O3是碱性氧化物,SiO2是酸性氧化物,因此有Al2O3+2NaOH=2NaAlO2+H2O,SiO2+2NaOH=Na2SiO3+H2O,Fe2O3不反应,因此滤液甲中溶质是NaAlO2、Na2SiO3、NaOH;②滤液甲中加入过量的稀盐酸,发生主要反应是AlO2-+4H+=Al3++2H2O,SiO32-+2H+=H2SiO3↓,滤液乙的主要成分是AlCl3,然后加入过量氨水,发生的离子反应式Al3++3NH3·H2O=Al(OH)3↓+3NH4+;③铝是活泼金属,工业上一般采用电解熔融状态的氧化铝冶炼铝单质,2Al2O3(熔融) ![]() 4Al+3O2↑。
4Al+3O2↑。

 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案