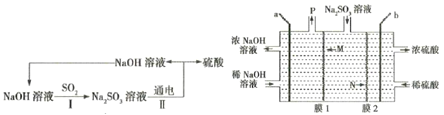
题目内容
【题目】25℃时,在20 mL0.1 mol·L-1一元弱酸HA溶液中滴加0.1 mol·L-1NaOH溶液,溶液中lg![]() 与pH关系如图所示。下列说法正确的是( )
与pH关系如图所示。下列说法正确的是( )
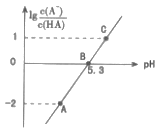
A.25℃时,HA酸的电离常数为1.0×10-5.3
B.A点对应溶液中:c(Na+)>c(A-)>c(H+)>c(OH-)
C.B点对应的NaOH溶液体积为10 mL
D.对C点溶液加热(不考虑挥发),则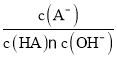 一定减小
一定减小
【答案】AD
【解析】
A. pH=5.3时,lg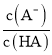 =0,即c(A-)=c(HA),HA酸的电离常数Ka=
=0,即c(A-)=c(HA),HA酸的电离常数Ka=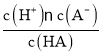 =c(H+)=10-pH=10-5.3,A正确;
=c(H+)=10-pH=10-5.3,A正确;
B. A点对应溶液显酸性,即c(H+)>c(OH-),溶液中存在电荷守恒,所以有关系式:c(Na+)+c(H+)=c(A-)+c(OH-),所以c(A-)>c(Na+),盐电离产生的离子浓度大于弱电解质电离产生的离子浓度,所以溶液中离子浓度关系为:c(A-)>c(Na+)>c(H+)>c(OH-),B错误;
C. 由于Ka=10-5.3>![]() =Kh,所以20 mL HA溶液中加入10 mL NaOH溶液,得到等浓度的HA和NaA混合溶液,混合溶液以电离为主,使c(A-)>c(HA),即lg
=Kh,所以20 mL HA溶液中加入10 mL NaOH溶液,得到等浓度的HA和NaA混合溶液,混合溶液以电离为主,使c(A-)>c(HA),即lg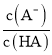 >0,故B点对应的NaOH溶液的体积小于10 mL,C错误;
>0,故B点对应的NaOH溶液的体积小于10 mL,C错误;
D. A-的水解常数Kh随温度升高而增大,所以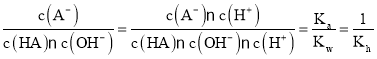 随温度升高而减小,D正确;
随温度升高而减小,D正确;
故合理选项是AD。

【题目】现有常温下pH=2的盐酸甲和pH=2的醋酸溶液乙,请根据下列操作回答问题:
(1)常温下0.lmol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定增大的是__________
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-) D.c(OH-)/c(H+)
(2)取10mL乙溶液,加入等体积水,醋酸的电离平衡___________(填“向左”、“向右”或“不”)移动;另取10mL的乙溶液,加入少量无水醋酸钠固体 (假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中c(H+)/c(CH3COOH)的比值将___________(填“增大”“ 减小”或“无法确定”)。
(3)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为:V(甲)___________V(乙) (填“>”、“ <”或“=”)。
(4)已知25℃时,两种酸的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数K1 | 1.8×l1-5 | 4.3×l0-7 | 3.0×10-8 |
K2 | - - | 5.6×10-11 | - - |
下列四种离子结合H+能力最强的是___________;
A.HCO3- B.CO32- C.ClO- D.CH3COO-
(5)常温下,取甲溶液稀释100倍,其pH=___________;取99mL甲溶液与lrnLlmol/L的NaOH溶液混合(忽略溶液体积变化),恢复至常温时其pH=______________。
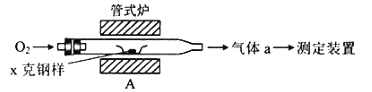
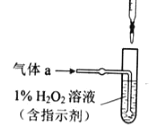
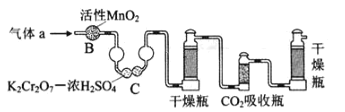
【题目】某小组进行实验:向硫酸酸化的过氧化氢溶液中加入碘化钾、淀粉和硫代硫酸钠的混合溶液,一段时间后溶液变蓝。查阅资料知体系中存在两个主要反应:
反应i:H2O2(aq) + 2I-(aq) + 2H+(aq) I2(aq) + 2H2O(l) ΔH1 = -247.5 kJ/mol
反应ii:I2(aq) + 2S2O32-(aq) 2I-(aq) + S4O62-(aq) ΔH2 = -1021.6 kJ/mol
(1)H2O2与S2O32-反应的热化学方程式为______。
(2)下列实验方案可证实上述反应过程。将实验方案补充完整(所用试剂浓度均为0.01 mol/L)。
a.向酸化的H2O2溶液中加入________溶液,溶液几秒后变为蓝色。
b._________,溶液立即褪色。
(3)探究c(H+)对反应速率的影响,实验方案如下表所示。(所用试剂除H2O以外,浓度均为0.01 mol/L)
实验序号 | a | b | |
试 剂 | H2O2/mL | 5 | ______ |
H2SO4/mL | 4 | 2 | |
Na2S2O3/mL | 8 | _____ | |
KI(含淀粉)/mL | 3 | _____ | |
H2O | 0 | ______ | |
将上述溶液迅速混合 观察现象 | 溶液变蓝所需时间 为t1秒 | 溶液变蓝所需时间 为t2秒 | |
① 将实验b补充完整。
② 对比实验a和实验b,t1_____t2(填“>”或“<”)。
③ 结合(2)中现象解释溶液混合后一段时间才变蓝的原因________。
④ 利用实验a的数据,计算t1时间内H2O2与S2O32-反应的平均反应速率(用H2O2浓度的变化表示)________mol/(L·s)。