��Ŀ����
����Ŀ��X��Y��Z��W��N�����ɶ�����Ԫ����ɵ����ֻ������֪���ֻ�����ˮ��Һ����ɫ��Ӧ���ʻ�ɫ��Y��Z��N��������Ԫ����ɣ��������ĿҪ��ش��������⣮
��1�����廯����XΪdz��ɫ��ĩ���û������к��еĻ�ѧ����������ţ���
A.���Ӽ�
B.���Թ��ۼ�
C.�Ǽ��Թ��ۼ�
D.���
��2��д��X�������̼��Ӧ�Ļ�ѧ����ʽ ��
��3���±�ΪY��Zʵ��IJ������ݣ�
��� | ��Ҫʵ�鲽�輰ʵ������ |
�� | �ں�Y����Һ�У�����ϡ������ã�����dz��ɫ��������ɫ�д̼�����ζ�����壬�������ʹƷ����Һ��ɫ |
�� | �ں�Z����Һ�У��μ����ᣬ��ʼ�а�ɫ�����������μ����ᣬ��ɫ���������Ӻ���ʧ��Ȼ���������İ�ˮ�ֳ��ְ�ɫ���� |
�� | ��ʵ������յõ��Ļ����������������գ����յõ���ɫ���� |
д��Y��ϡ���ᷴӦ�����ӷ���ʽ ��
��4��д����0.1mol Z����Һ��20mL 5molL��1�����ᷴӦ�����ӷ�Ӧʽ �� ʵ��ۼ������������յõ������ղ�����Ҫ�� ��
��5��������W��N�����ת����W ![]() N������W��NxH2O�Ļ����6.52g�����ȵ���ȫ��Ӧ���������ͨ��Ũ��������1.71g��ʣ������ͨ����ʯ������1.10g����������W������Ϊ �� NxH2O�Ļ�ѧʽΪ ��
N������W��NxH2O�Ļ����6.52g�����ȵ���ȫ��Ӧ���������ͨ��Ũ��������1.71g��ʣ������ͨ����ʯ������1.10g����������W������Ϊ �� NxH2O�Ļ�ѧʽΪ ��
���𰸡�
��1��AC
��2��2Na2O2+2CO2=2Na2CO3+O2
��3��S2O32��+2H+=S��+SO2��+H2O
��4��AlO2��+H2O+H+=Al��OH��3����Al2O3
��5��4.2g��Na2CO3.7H2O
���������⣺X��Y��Z��W��N�����ɶ�����Ԫ����ɵ����ֻ�������ֻ�����ˮ��Һ����ɫ��Ӧ���ʻ�ɫ��������NaԪ�أ�Y��Z��N��������Ԫ����ɣ���1�����廯����XΪdz��ɫ��ĩ����XΪNa2O2 �� �����������������֮���γ����Ӽ��������������д��ڷǼ��Լ�����ѡ��AC����2�����������������̼��Ӧ����̼��������������Ӧ����ʽΪ��2Na2O2+2CO2=2Na2CO3+O2 �� ���Դ��ǣ�2Na2O2+2CO2=2Na2CO3+O2����3��ʵ����ں�Y����Һ�У�����ϡ������ã�����dz��ɫ��������ɫ�д̼�����ζ�����壬�������ʹƷ����Һ��ɫ��YΪNa2S2O3 �� Y��ϡ���ᷴӦ�����ӷ���ʽ��S2O32��+2H+=S��+SO2��+H2O�����Դ��ǣ�S2O32��+2H+=S��+SO2��+H2O����4��ʵ����ں�Z����Һ�У��μ����ᣬ��ʼ�а�ɫ�����������μ����ᣬ��ɫ���������Ӻ���ʧ��Ȼ���������İ�ˮ�ֳ��ְ�ɫ��������ZΪNaAlO2 �� HCl���ʵ���Ϊ0.02L��5mol/L=0.1mol��NaAlO2��HCl���ʵ���֮��Ϊ1��1������ǡ�÷�����Ӧ��NaAlO2+HCl+H2O=Al��OH��3��+NaCl����Ӧ���ӷ���ʽΪ��AlO2��+H2O+H+=Al��OH��3����ʵ��۽�ʵ������յõ��Ļ����������������գ����������ֽ����յõ���ɫ����ΪAl2O3 �� ���Դ��ǣ�AlO2��+H2O+H+=Al��OH��3����Al2O3����5��W����ȷֽ�õ�N��N�������̼��ˮ��Ӧ�õ�W����֪WΪNaHCO3��NΪNa2CO3 �� ����NaHCO3��Na2CO3xH2O�Ļ����6.52g�����ȵ���ȫ��Ӧ���������ͨ��Ũ��������1.71gΪ�ᾧˮ��̼�����Ʒֽ�����ˮ������֮�ͣ�ʣ������ͨ����ʯ������1.10gΪ̼�����Ʒֽ����ɶ�����̼����������NaHCO3��Na2CO3xH2O�����ʵ����ֱ�Ϊamol��bmol����
2NaHCO3 ![]() Na2CO3+CO2��+H2O
Na2CO3+CO2��+H2O
amol 0.5amol 0.5amol
Na2CO3 �� xH2O ![]() Na2CO3+xH2O
Na2CO3+xH2O
bmol xb mol
����Ũ�������أ��ɵã���0.5a+xb����18=1.71
���ݼ�ʯ�����أ��ɵã�0.5a��44=1.10
���ݻ�������������ɵã�84a+��106+18x��b=6.52
�������̣����a=0.05��b=0.01��x=7��
��m��2NaHCO3��=0.05mol��84g/mol=4.2g��
NxH2O�Ļ�ѧʽΪΪ��Na2CO3.7H2O��
���Դ��ǣ�4.2g��Na2CO3.7H2O��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ������ݻ�ѧ��Ӧ�����ܵ��й�֪ʶ����д���пհף�
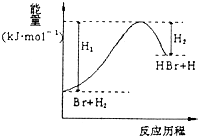
I. ��1�����Ц�H��ʾ����ȼ���ȵ���________����ʾ��Ӧ�к��Ȧ�H����57.3 kJ��mol��1����________(���H1������H2���͡���H3����)��
A��C(s)��![]() O2(g)===CO(g) ��H1
O2(g)===CO(g) ��H1
B��2H2(g)��O2(g)===2H2O(l) ��H2
C��C(s)��O2(g)===CO2(g) ��H3
D��![]() Ba(OH)2(aq)��
Ba(OH)2(aq)��![]() H2SO4(aq)===
H2SO4(aq)===![]() BaSO4(s)��H2O(l) ��H4
BaSO4(s)��H2O(l) ��H4
E��NaOH(aq)��HCl(aq)===NaCl(aq)��H2O(l) ��H5
F��2NaOH(aq)��H2SO4(aq)===Na2SO4(aq)��2H2O(l) ��H6
(2)��ѧ��Ӧ�������仯(��H)�뷴Ӧ���������ļ����й�(���ܿ��Լ�����Ϊ�Ͽ�1 mol��ѧ��ʱ�������յ�����)���±��Dz��ֻ�ѧ���ļ������ݣ�
��ѧ�� | P��P | P��O | O=O | P=O |
����(kJ��mol��1) | a | 360 | 500 | 434 |
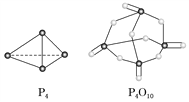
��֪����(P4)��ȼ����Ϊ2 378 kJ��mol��1��������ȫȼ�յIJ���(P4O10)�Ľṹ����ͼ��ʾ�����ϱ���a��________(����������)��
II.��֪2mol����ȼ������Һ̬ˮʱ�ų�572KJ��������Ӧ���Ȼ�ѧ����ʽ��2H2��g��+O2��g��=2H2O��l�� ��H=-572KJ��mol-1��
��3���÷�Ӧ������������ܺ�______������ڡ���С�ڡ����ڡ�����Ӧ��������ܺ͡�
��4����2mol������ȫȼ������ˮ��������ų�������_______�������������������572KJ��
III.��5����֪16g��������ȫȼ��ʱ�ų�148.4KJ��������д����ʾ���ȼ���ȵ��Ȼ�ѧ����ʽ��____________________________________��
��6����ͼ��ʾ��1 mol NO2��CO��Ӧ����CO2��NO�����������仯ʾ��ͼ��

��д��NO2��CO��Ӧ���Ȼ�ѧ����ʽ��_______________________________��