��Ŀ����
����Ŀ�������£���0.01molL��1 NaOH��Һ�ζ�20.00mL 0.01molL��1 CH3COOH��Һ�����õζ�������ͼ������˵����ȷ���ǣ� �� 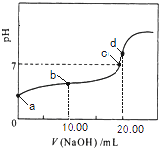
A.a���Ӧ��Һ��pH=2
B.b���Ӧ����Һ�У�c��OH����+c��CH3COO����=c��Na+��+c��H+��
C.c���ʾNaOH��Һ��CH3COOH��Һǡ����ȫ��Ӧ
D.d���Ӧ����Һ�У�ˮ�ĵ���̶�С��ͬ���´�ˮ�ĵ���̶�
���𰸡�B
���������⣺A������Ϊ���ᣬ������ȫ���룬��0.01molL��1 CH3COOH��ҺpH��2����A����B����Һ�д��ڵ���غ㣺c��Na+��+c��H+��=c��OH����+c��CH3COO��������B��ȷ��
C��������������Ʒ�Ӧ���ɴ����ƣ���������ǿ����������ˮ��Һ�ʼ��ԣ������ǡ�÷�Ӧʱ��ҺӦ�óʼ��ԣ���C����Һ�����ԣ�˵�����������C����
D��d��ʱ��Һ�ʼ��ԣ������ǡ���кͣ���ȫ��Ӧ���ɴ����ƣ�ˮ��ʼ��ԣ��ٽ�ˮ�ĵ��룬��D����
��ѡB��

 �п�������㾫��ϵ�д�
�п�������㾫��ϵ�д� ������ĩ��ϰ��ѵ��ϵ�д�
������ĩ��ϰ��ѵ��ϵ�д�����Ŀ��X��Y��Z��W��N�����ɶ�����Ԫ����ɵ����ֻ������֪���ֻ�����ˮ��Һ����ɫ��Ӧ���ʻ�ɫ��Y��Z��N��������Ԫ����ɣ��������ĿҪ��ش��������⣮
��1�����廯����XΪdz��ɫ��ĩ���û������к��еĻ�ѧ����������ţ���
A.���Ӽ�
B.���Թ��ۼ�
C.�Ǽ��Թ��ۼ�
D.���
��2��д��X�������̼��Ӧ�Ļ�ѧ����ʽ ��
��3���±�ΪY��Zʵ��IJ������ݣ�
��� | ��Ҫʵ�鲽�輰ʵ������ |
�� | �ں�Y����Һ�У�����ϡ������ã�����dz��ɫ��������ɫ�д̼�����ζ�����壬�������ʹƷ����Һ��ɫ |
�� | �ں�Z����Һ�У��μ����ᣬ��ʼ�а�ɫ�����������μ����ᣬ��ɫ���������Ӻ���ʧ��Ȼ���������İ�ˮ�ֳ��ְ�ɫ���� |
�� | ��ʵ������յõ��Ļ����������������գ����յõ���ɫ���� |
д��Y��ϡ���ᷴӦ�����ӷ���ʽ ��
��4��д����0.1mol Z����Һ��20mL 5molL��1�����ᷴӦ�����ӷ�Ӧʽ �� ʵ��ۼ������������յõ������ղ�����Ҫ�� ��
��5��������W��N�����ת����W ![]() N������W��NxH2O�Ļ����6.52g�����ȵ���ȫ��Ӧ���������ͨ��Ũ��������1.71g��ʣ������ͨ����ʯ������1.10g����������W������Ϊ �� NxH2O�Ļ�ѧʽΪ ��
N������W��NxH2O�Ļ����6.52g�����ȵ���ȫ��Ӧ���������ͨ��Ũ��������1.71g��ʣ������ͨ����ʯ������1.10g����������W������Ϊ �� NxH2O�Ļ�ѧʽΪ ��
����Ŀ����1�����ǵ����Ϻ����ḻ��һ��Ԫ�أ������仯�����ڹ�ũҵ������������������Ҫ���ã���ͼ��N2(g)��H2(g)��Ӧ����1mo1NH3(g)�����������仯ʾ��ͼ��

��д��N2��H2��Ӧ���Ȼ�ѧ����ʽ��_____________________________��
��2������֪�������ݣ�
��ѧ�� | H-H | N��N |
����/kJmol-1 | 435 | 943 |
�Ը��ݱ��м�ͼ�����ݼ���N-H�ļ���______kJmol-1
��3����֪100ml lmol/L������������Һ������������Һ��ȫ��Ӧ�ų�5.73kJ����������д����ʾ�к��ȵ��Ȼ�ѧ����ʽ________________________________��
��4����֪1��������ȫȼ������Һ̬ˮʱ�ų�akJ����������д����ʾ����ȼ���ȵ��Ȼ�ѧ����ʽ____________________________________________��