题目内容
12.某研究性学习小组查阅资料得知,漂白粉与硫酸反应可以制得氯气,化学方程式为:Ca(ClO)2+CaCl2+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2CaSO4+2Cl2↑+2H2O.他们设计了如下制取氯气并验证其性质的实验.试回答: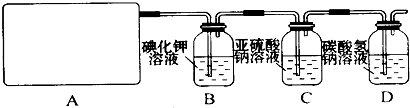
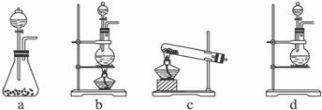
(1)该实验中A部分的装置是b(填写装置的序号).
(2)请你设计一个实验,证明洗气瓶C中的Na2SO3已经被氧化(简述实验步骤):取少量溶液置于洁净的试管中,向其中滴加稀盐酸至不再产生气体,再向其中滴入氯化钡溶液,若产生白色沉淀,证明亚硫酸钠被氧化.
(3)写出D装置中发生反应的离子方程式Cl2+H2O═H++Cl-+HClO、H++HCO3-═CO2↑+H2O.
分析 (1)根据反应物的状态及反应条件选择发生装置;
(2)氯气有强氧化性,亚硫酸根离子有还原性,所以氯气和亚硫酸根离子能发生氧化还原反应生成硫酸根离子、氯离子和氢离子;如果亚硫酸钠被氧化会生成硫酸钠,根据硫酸根离子的检验方法检验即可;
(3)氯气和水反应生成盐酸和次氯酸,盐酸能和碳酸氢根离子反应生成二氧化碳.
解答 解:(1)A部分用于制取Cl2,根据所给Cl2的生成反应的反应物状态和反应是否需要加热选择气体发生装置,应选属于“固+液$\frac{\underline{\;\;△\;\;}}{\;}$气”型的b,故答案为:b;
(2)Na2SO3氧化的产物为Na2SO4,确定存在SO42-即可证明Na2SO3已部分被氧化.检验时,应取C中溶液少许于洁净试管中,先加稀HCl至不再产生气体以排除SO32-的干扰,然后再加入BaCl2溶液,若产生白色沉淀,则证明Na2SO3已部分被氧化,
故答案为:取少量溶液置于洁净的试管中,向其中滴加稀盐酸至不再产生气体,再向其中滴入氯化钡溶液,若产生白色沉淀,证明亚硫酸钠被氧化;
(3)进入D的Cl2与水反应的离子方程式为Cl2+H2O?H++Cl-+HClO,HCl能与NaHCO3反应,离子方程式为H++HCO3-=CO2↑+H2O,HClO因酸性比H2CO3弱而不能与NaHCO3反应,故答案为:Cl2+H2O═H++Cl-+HClO、H++HCO3-═CO2↑+H2O.
点评 本题考查氯气的制备以及性质检验,为高频考点,侧重于学生的分析、实验能力的考查,题目难度中等,注意亚硫酸根离子的检验首先要排除硫酸根离子的干扰.

练习册系列答案
相关题目
13.在一定温度下的在2L密闭容器中加入一定量的炭和水蒸气发生如下反应:C(s)+H2O(g)?CO(g)+H2(g)△H>0,可认定该可逆反应在一定条件下已达到化学平衡状态的是( )
| A. | 容器中H2O、CO、H2的物质的量之比为1:1:1 | |
| B. | v正(CO)=v逆(H2O) | |
| C. | 生成n molCO的同时生成n mol H2 | |
| D. | 1mol H-H键断裂同时生成2mol H-O键 |
3.目前我省不少城市居民所使用的燃料主要是管道煤气,有的地方已经开始使用天然气作为民用燃料.管道煤气的主要成分是CO、H2和少量烃类,天然气的主要成分是CH4.它们的燃烧反应如下:
2CO+O2$\stackrel{点燃}{→}$2CO2 2H2+O2$\stackrel{点燃}{→}$2H2O CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O
根据以上化学方程式判断:燃烧相同体积的管道煤气和天然气,消耗空气体积较大的是天然气.因此燃烧管道煤气的灶具如需改烧天然气,灶具的改进方法是增大进风口(填增大或减小),如不作改进可能产生的不良结果是天然气不能充分燃烧,可能生成有毒的CO
管道煤气中含有的烃类,除甲烷外,还有少量乙烷、丙烷、丁烷等,它们的某些性质见下表:
试根据以上某个关键数据解释冬天严寒的季节有时管道煤气火焰很小,并且呈断续状态的原因是丁烷遇冷凝结为液体使管道内气流不畅.
2CO+O2$\stackrel{点燃}{→}$2CO2 2H2+O2$\stackrel{点燃}{→}$2H2O CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O
根据以上化学方程式判断:燃烧相同体积的管道煤气和天然气,消耗空气体积较大的是天然气.因此燃烧管道煤气的灶具如需改烧天然气,灶具的改进方法是增大进风口(填增大或减小),如不作改进可能产生的不良结果是天然气不能充分燃烧,可能生成有毒的CO
管道煤气中含有的烃类,除甲烷外,还有少量乙烷、丙烷、丁烷等,它们的某些性质见下表:
| 乙烷 | 丙烷 | 丁烷 | |
| 熔点(℃) | -183.3 | -189.7 | -138.4 |
| 沸点(℃) | -88.6 | -42.1 | -0.5 |
20.以下实验能获得成功的是( )
| A. | 要检验溴乙烷中的溴元素,可以加入NaOH溶液共热,冷却后滴入AgNO3溶液,观察有无浅黄色沉淀生成 | |
| B. | 要检验蔗糖的水解产物,将蔗糖的水解液加入到新制的氢氧化铜悬浊液中,加热至沸腾观察是否有红色沉淀产生 | |
| C. | 在进行溴乙烷与NaOH乙醇溶液反应的实验中,将反应产生的气体直接通入到酸性高锰酸钾溶液中来检验产生的气体是否为乙烯 | |
| D. | 将铜丝在酒精灯上加热变黑后,立即伸入盛有无水乙醇的试管中,铜丝恢复成原来的红色,取出,铜丝又会变为黑色,反复几次,用氢氧化铜悬浊液可以证明是否生成了乙醛 |
7.下列叙述不正确的是( )
| A. | 乙烯、油脂、天然橡胶和蛋白质分子中均含有双键 | |
| B. | 相同物质的量的甲基、羟基或氨基所含的电子数目相同 | |
| C. | 常温常压下,3.0g葡萄糖和冰醋酸的混合物中含有的原子总数不为定值 | |
| D. | 利用红外光谱仪记录的红外光谱图可以初步推测有机化合物中官能团的类别 |
17.下列各实验装置图的叙述中,正确的是( )
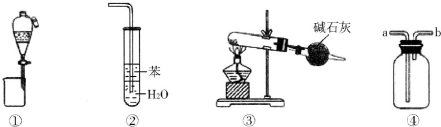

| A. | 装置①可用于分离苯和溴苯的混合物 | |
| B. | 装置②可用于吸收氨气,且能够防止倒吸 | |
| C. | 以NH4Cl为原料,装置③可用于制备NH3 | |
| D. | 剩用装置④可收集Cl2、H2等气体,盛满水时还能收集NO等气体 |
2.下列各组物质可用分液漏斗分离的是( )
| A. | 乙酸与乙酸乙酯 | B. | 溴苯与水 | C. | 酒精与水 | D. | 苯与CCl4 |
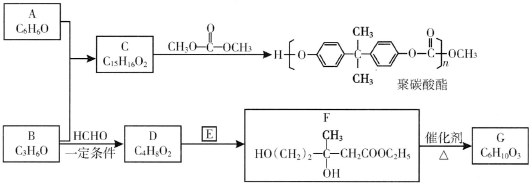
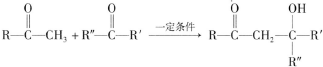 (R、R′、R″为氢原子或烃基)
(R、R′、R″为氢原子或烃基)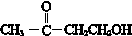 ,E的分子式是C4H8O2,F生成G的反应类型是取代反应?
,E的分子式是C4H8O2,F生成G的反应类型是取代反应?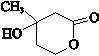 .G的同分异构体有多种,其中和G具有完全相同环状结构的同分异构体有23种(不包含G,不考虑立体异构).
.G的同分异构体有多种,其中和G具有完全相同环状结构的同分异构体有23种(不包含G,不考虑立体异构).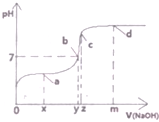 (1)25℃时,向20mL0.1mol•L的醋酸溶液中不断滴入0.1mol•L-1的NaOH溶液,溶液的pH变化曲线如图所示.
(1)25℃时,向20mL0.1mol•L的醋酸溶液中不断滴入0.1mol•L-1的NaOH溶液,溶液的pH变化曲线如图所示.