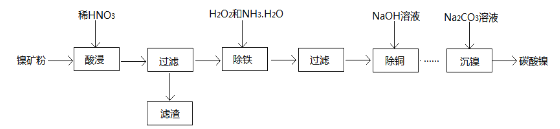
题目内容
【题目】下列化学用语正确的是
A. 丙烯的电子式为: ![]()
B. 二乙酸乙二酯的结构简式为: ![]()
C. 苯酚钠溶液中通入少量CO2的离子方程式为:![]() +H2O+CO2
+H2O+CO2![]()
![]() +HCO3—
+HCO3—
D. 甲醛与足量的银氨溶液反应的化学方程式为:HCHO+2Ag(NH3)2OH ![]() HCOONH4+2Ag↓+3NH3+H2O
HCOONH4+2Ag↓+3NH3+H2O
【答案】C
【解析】A.丙烯中有碳碳双键,双键是两个共用电子对,故A错误;B.给出的结构间式是乙二酸二乙酯的结构简式,故B错误;C.碳酸的酸性比苯酚强,苯酚钠中通入二氧化碳生成的产物是苯酚和碳酸氢根,故C正确;D.甲醛与足量的银氨溶液反应,醛基中的两个氢均可以被氧化,故方程式为HCHO+4[Ag(NH3)2]OH→4Ag↓+6NH3↑+ (NH4)2CO3+2H2O;故选C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】(1)请写出泡沫灭火器(硫酸铝和碳酸氢钠溶液) 灭火时发生反应的离子方程式:_______________。
(2)常温下若溶液由pH=3的HA溶液V1mL 与pH=11的NaOH溶液V2mL混合而得正确的有_______________。
A.若混合后溶液呈中性:c(H+)+c(OH-)=2×10-7mol/L
B.若V1=V2,混合后溶液pH一定等于7
C.若混合后溶液呈酸性,则V1一定大于V2
D.若混合后溶液呈碱性,则V1一定小于V2
(3)常温下,浓度均为0.1mol/L的下列五种溶液的pH如表所示:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
①根据表中数据,将浓度均为0.01mo/L的下列四种酸的溶液分别稀释100倍,pH变化最小的是_________。
A.HCN B.HClO C.H2CO3 D.CH3COOH
②根据以上数据,判断下列反应可以成立的是_________。
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO
D.NaHCO3+HCN=NaCN+H2O+CO2↑
(4)某温度时,测得0.01mol·L-1 的NaOH溶液的pH为10。若将此温度下pH=10的NaOH 溶液aL与pH=1的稀硫酸bL混合,(设混合后溶液体积的微小变化忽略不计),若所得混合液pH=2,则a:b=_______。
(5)25℃,用0.1000 mol/LNaOH 溶液滴定20.00mL0.1000mol/L 某一元酸HA溶液所得滴定曲线如图。

①为减小实验误差,滴定时应选用适当的指示剂,判断该滴定终点的现象为(必须描述颜色的变化)______________________。
②A、B、C三点所示溶液导电能力最强的是___________点对应的溶液;
③比较A、C两点中水的电离程度:A_______C (填“>”、“ =”或“<”)。
(6)H2C2O4与含等物质的量的KOH的溶液反应后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为______________________。
(7)某酸性CuCl2溶液中含少量的FeCl3,为制得纯净CuCl2溶液,宜加入__________调至溶液pH=4,使Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=_________mol/L。[Fe(OH)3的Ksp=2.6×10-39]