题目内容
8.铁及其化合物在日常生活中有广泛应用.(1)写出Fe与稀H2SO4反应的化学方程式Fe+H2SO4=FeSO4+H2↑.
(2)绿矾(FeSO4•7H2O) 是补血剂的原料,易变质,检验是否变质的试剂是KSCN溶液.
(3)聚合硫酸铁(PFS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理,用铁的氧化物为原料来制取聚合硫酸铁,为控制水解时Fe 3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe2+,实验步骤如下:

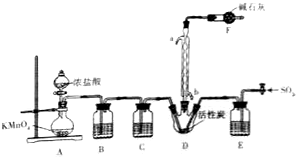
①用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒、玻璃棒外,还有b(选填标号)
a.容量瓶 b.烧杯 c.烧瓶
②Ⅲ中主要反应的离子方程式是Fe+2Fe3+=3Fe2+.
③写出Ⅳ中用NaClO3氧化Fe2+时的离子反应方程式ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O,若改用HNO3氧化,则反应方程式如下:6FeSO4+2HNO3+3H2SO4═3Fe2(SO4)3+2NO↑+4H2O 但缺点是产生的气体对空气有污染.
聚合硫酸铁的化学式是[Fe2(OH)n(SO4)3-0.5n]m,运用沉淀法测定聚合硫酸铁产品溶液中Fe3+与SO${\;}_{4}^{2-}$物质的量之比.
④需要测定Fe2O3和BaSO4的质量(填写化合物的化学式).
⑤测定过程中所需的基本操作除过滤、洗涤外,还有cd(选填标号)
a.萃取、分液 b.蒸发、结晶 c.冷却、称量 d.烘干或灼烧.
分析 (1)Fe与稀H2SO4反应生成硫酸亚铁和氢气;
(2)绿矾(FeSO4•7H2O) 是补血剂的原料,易变质,检验是否变质即检验三价铁离子,可以用KSCN溶液;
(3)铁的氧化物溶解于硫酸中取样分析溶液中的Fe2+、Fe3+的含量,因为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+先被还原为Fe2+;所以确定下一步还原所需铁的量,再被氧化为Fe3+;需要确定氧化Fe2+所需NaClO3的量,通过氧化、水解、聚合得到产品,
①根据配制一定质量分数溶液的基本步骤:计算、量取、溶解分析用到的仪器;
②Ⅲ中主是用铁将Fe3+还原为Fe2+;
③用NaClO3氧化Fe2+时,氯酸根离子被还原成氯离子,亚铁离子被氧化成铁离子,结合电子守恒和原子守恒书写离子方程式,用硝酸氧化产物中有一氧化氮;
④根据测定Fe2O3来测定Fe3+的物质的量,根据测定 BaSO4的质量来测定SO42?的物质的量考虑;
⑤根据测定沉淀的质量分析基本步骤,从溶液中获得沉淀,要先过滤、洗涤,烘干,冷却再称量沉淀质量,根据沉淀质量再进行计算即可.
解答 解:(1)Fe与稀H2SO4反应生成硫酸亚铁和氢气,反应方程式为Fe+H2SO4=FeSO4+H2↑,
故答案为:Fe+H2SO4=FeSO4+H2↑;
(2)绿矾(FeSO4•7H2O) 是补血剂的原料,易变质生成三价铁离子,检验是否变质即检验三价铁离子,可以用KSCN溶液,
故答案为:KSCN溶液;
(3)铁的氧化物溶解于硫酸中取样分析溶液中的Fe2+、Fe3+的含量,因为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+先被还原为Fe2+;所以确定下一步还原所需铁的量,再被氧化为Fe3+;需要确定氧化Fe2+所需NaClO3的量,通过氧化、水解、聚合得到产品,
①用浓硫酸配稀硫酸的基本步骤是计算、量取、溶解,配制一定量分数硫酸溶液需要的仪器有:胶头滴管、量筒、玻璃棒、烧杯,
故答案为:b;
②Ⅲ中主是用铁将Fe3+还原为Fe2+,反应的离子方程式为Fe+2Fe3+=3Fe2+,
故答案为:Fe+2Fe3+=3Fe2+;
③用NaClO3氧化Fe2+时,氯酸根离子被还原成氯离子,亚铁离子被氧化成铁离子,反应的离子方程式为ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O,如果用用硝酸氧化,则产物中有一氧化氮,污染空气,
故答案为:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O;产生的气体对空气有污染;
④根据测定Fe2O3来测定Fe3+的物质的量,根据测定 BaSO4的质量来测定SO42?的物质的量考虑,
故答案为:BaSO4;
⑤根据测定沉淀的质量分析基本步骤,从溶液中获得沉淀,要先过滤、洗涤,烘干或灼烧,冷却再称量沉淀质量,根据沉淀质量再进行计算即可,
故选cd.
点评 本题以铁及其化合物为载体,以流程图形式考查了氧化还原反应知识、元素化合物的知识,注意溶液配制方法和步骤,测定物质含量的实验刚才分析判断,题目难度较大.

 阅读快车系列答案
阅读快车系列答案
有关说法正确的是( )
| A. | 西维因分子式为C12H10NO2 | |
| B. | 西维因分子中至少有21个原子共平面 | |
| C. | 1mol西维因最多能与6mol氢气发生加成反应 | |
| D. | 反应后的溶液经酸化,可用FeCl3溶液检验西维因是否已经发生水解 |
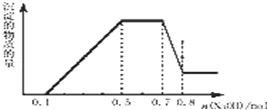 溶液中可能含有 H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①加入铝片,产生无色无味的气体;②加入 NaOH 溶液,产生白色沉淀,且产生的沉淀量与加入 NaOH 的物质的量之间的关系如图所示.则下列说法正确的是( )
溶液中可能含有 H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①加入铝片,产生无色无味的气体;②加入 NaOH 溶液,产生白色沉淀,且产生的沉淀量与加入 NaOH 的物质的量之间的关系如图所示.则下列说法正确的是( )| A. | 溶液中一定不含 CO32-,可能含有 SO42-和 NO3- | |
| B. | n(H+):n(NH4+):n(Mg2+)=2:4:1 | |
| C. | 溶液中的阳离子只有 H+、Mg2+、Al3+ | |
| D. | 在滴加 NaOH 溶液物质的量为 0.5 至 0.7mol 时,发生的离子反应为:Al3++4OH-=AlO2-+2H2O |
C6H12O6(葡萄糖)+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr
2C6H12O7(葡萄糖酸)+CaCO3→Ca(C6H11O7)2(葡萄糖酸钙)+H2O+CO2↑
相关物质的溶解性见表:
| 物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
| 水中的溶解性 | 可溶于冷水、易溶于热水 | 可溶 | 易溶 | 易溶 |
| 乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |
C6H12O6溶液$→_{①}^{滴加3%溴水/55℃}$$→_{②}^{过量CaCO_{3}/70℃}$$→_{③}^{趁热过滤}$$→_{④}^{乙醇}$ 悬浊液$→_{⑤}^{抽滤}$$→_{⑥}^{洗涤}$$→_{⑦}^{干燥}$ Ca(C6H11O7)2
请回答下列问题:
(1)第①步中溴水氧化葡萄糖时,如图装置最适合的是:B.

制备葡萄糖酸钙的过程中,葡萄糖的氧化也可用其它试剂,下列物质中最适合的是C.
A.新制Cu(OH)2悬浊液 B.酸性KMnO4溶液 C.O2/葡萄糖氧化酶 D.[Ag(NH3)2]OH溶液
(2)第②步充分反应后CaCO3固体需有剩余,其目的是提高葡萄糖酸的转化率,便于后续分离;本实验中不宜用CaCl2替代CaCO3,理由是氯化钙难以与葡萄糖酸直接反应生成葡萄糖酸钙沉淀.
(3)第③步需趁热过滤,其原因是葡萄糖酸钙冷却后结晶析出,如不趁热过滤会损失产品.
(4)第④步加入乙醇的作用是可降低葡萄糖酸钙在溶剂中的溶解度,有利于葡萄糖酸钙析出.
(5)第⑥步中,下列洗涤剂最合适的是D.
A.冷水 B.热水 C.乙醇 D.乙醇-水混合溶液.
| 名称 | 形状 | 熔点(℃) | 沸点(℃) | 密度(g•mL-1) | 溶解性 | |
| 水 | 乙醇 | |||||
| 甲苯 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | 互溶 |
| 苯甲酸 | 白色片状或针状晶体 | 112.4(100℃左右升华) | 248 | 1.2659 | 微溶 | 易溶 |
| 温度/℃ | 4 | 18 | 75 |
| 溶解度/g | 0.2 | 0.3 | 2.2 |
(1)按如图组装反应装置(冷凝水、夹持及加热装置未画出),并在三颈烧瓶中依次加入120mL水,9.4g高锰酸钾和3.0mL甲苯.装置a的名称是冷凝管,其作用为冷凝回流,防止甲苯挥发而降低苯甲酸的产率.
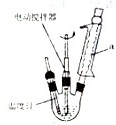
(2)将三颈烧瓶中的混合液体搅拌、加热至沸腾,直到甲苯完全反应.判断甲苯已完全反应的现象是三颈烧瓶内溶液不分层且回流液不再出现油珠.
(3)趁热过滤反应混合物.若绿叶呈紫色,则需加入适量的亚硫酸氢钠溶液至紫色褪去后再过滤,用热水洗涤滤渣,洗涤液合并至滤液中.若KMnO4被还原为MnO2,则KMnO4溶液与NaHSO3反应的离子方程式为2MnO4-+3HSO3-+OH-=2MnO2↓+3SO42-+2 H2O.
(4)用冰水冷却滤液,然后用浓盐酸酸化,过滤,用少量冷水洗涤滤渣,得到苯甲酸粗产品,经重结晶得到粗制的苯甲酸,用少量冷水洗涤滤渣的原因是减少苯甲酸因溶解而造成的损失,苯甲酸粗产品除了可用重结晶法精制外,还可用C法(选填字母).
A.溶于水后过滤 B.用甲苯萃取后分液 C.升华
(5)精制的苯甲酸纯度测定:称取1.220g样品,用稀乙醇溶解并配成100mL溶液,分别取25.00mL溶液,用0.1000mol•L-1NaOH标准溶液滴定,三次滴定消耗NaOH溶液的体积分别为V1=24.70ml,V2=24.80ml,V3=26.80ml.
①配制溶液时用稀乙醇而不用蒸馏水作溶剂的原因是常温下苯甲酸微溶于水而易溶于乙醇.
②若用酚酞作指示剂,确定滴定终点的现象是加入最后一滴NaOH溶液,溶液由无色变为浅红色,且保持30秒不变色.
③产品的纯度为99.00%.
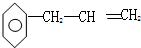 的性质叙述不正确的是( )
的性质叙述不正确的是( )| A. | 能使高锰酸钾溶液褪色 | B. | 能使溴水褪色,且静置后分层 | ||
| C. | 不能发生取代反应 | D. | 可以燃烧 |