题目内容
能用键能知识解释的是
| A.稀有气体的化学性质很不活泼 | B.HCl气体比HI气体稳定 |
| C.干冰易升华 | D.HF熔沸点高于HCl |
B
解析试题分析:A.稀有气体是单原子分子,不存在化学键。由于原子是2电子或8电子的稳定结构,所以化学性质很不活泼。错误。B.由于非金属性Cl>I。元素的非金属性越强,其单质与氢气结合的越牢固,键能越大,相应的氢化物的稳定性就越强,因此HCl气体比HI气体稳定。正确。C.固态CO2俗称干冰。是分子晶体,依靠分子间作用力结合。升华时破坏的的是分子间作用力。由于分子间作用力比较弱,所以易升华。与化学键的键能单质无关。错误。D.HF、HCl但是分子晶体,依靠分子间作用力结合。在HF分子间除了存在分子间作用力外,还存在氢键,增加了分子之间的相互作用,使物质熔化或气化消耗的能量比HCl多。因此熔沸点高于HCl。但是这与分子内的化学键的键能大小无关。错误。
考点:考查物质的性质与化学键的键能的关系的知识。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列说法不正确的是
| A.在共价化合物中一定含有共价键 |
| B.含有离子键的化合物一定是离子化合物 |
| C.含有共价键的化合物一定是共价化合物 |
| D.化学反应过程中,反应物分子内的化学键断裂,产物分子的化学键形成 |
下列关于化合物的说法正确的是:
| A.只含有共价键的物质一定是共价化合物 |
| B.由两种原子组成的纯净物一定是化合物 |
| C.熔化后不导电的化合物一定是共价化合物 |
| D.不含非极性键的化合物一定是共价化合物 |
下列有关化学键的叙述,正确的是( )
| A.分子晶体中一定含有共价键 | B.离子晶体中一定含有离子键 |
| C.含有极性键的分子一定是极性分子 | D.含有共价键的化合物一定是共价化合物 |
下列说法中,不正确的是( )
| A.双原子分子中的共价键,一定是非极性键 |
| B.非极性键也可能存在于离子化合物中 |
| C.分子间作用力,又叫范德华力,它比化学键要弱得多 |
| D.共价化合物在液态时不能导电 |
下列晶体或分子中,含有化学键类型有差异的一组是
| A.NH3、NO2。 | B.NaCl、KF |
| C.NaOH、Ca(OH)2 | D.MgO、H2O2 |
氮化硼是一种新合成的结构材料,具有超硬、耐磨、耐高温的特点。下列各组物质熔化时,所克服的微粒间作用力与氮化硼熔化所克服的微粒间作用力都不相同的是
| A.氯化钠和金刚石 | B.晶体硅和二氧化硅 |
| C.冰和干冰 | D.二氧化硫和二氧化硅 |
现代无机化学对硫-氮化合物的研究是最为活跃的领域之一。其中下图是已经合成的最著名的硫-氮化合物的分子结构。下列说法正确的是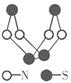
| A.该物质的分子式为SN | B.该物质的晶体中微粒间作用力有2种 |
| C.该物质具有很高的熔、沸点 | D.该物质与化合物S2N2互为同素异形体 |
甲、乙、丙、丁四种物质均为只含两种元素的化合物,且均含18个电子。下列有关这
四种物质的推断,正确的是( )
| A.可能在某种物质中含有离子键 |
| B.四种物质都是共价化合物 |
| C.四种物质都不可能具有强氧化性 |
| D.有一种物质是乙烷的同系物 |