题目内容
下列有关化学键的叙述,正确的是( )
| A.分子晶体中一定含有共价键 | B.离子晶体中一定含有离子键 |
| C.含有极性键的分子一定是极性分子 | D.含有共价键的化合物一定是共价化合物 |
B
解析试题分析:A.在惰性气体的分子内不含化学键,因此分子晶体中不一定含有共价键。错误。B.含有离子键的化合物是离子化合物。离子化合物在固态时是属于离子晶体的。因此离子晶体中一定含有离子键。正确。C.含有极性键的分子若各个化学键的排列是对称的就是非极性分子,否则就是极性分子。错误。D.含有共价键的化合物可能是共价化合物如HCl,也可能是离子化合物如NaOH等。
考点:考查化学键与物质的关系的知识。

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
下列说法正确的是
| A.冰熔化时,分子中H—O键发生断裂 |
| B.NaOH中只含有离子键 |
| C.CO2与SiO2都属于分子晶体 |
| D.熔沸点由高到低的顺序是金刚石>NaCl>I2 |
下列结构中,从成键情况看,不合理的是
A. | B.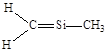 | C.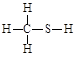 | D.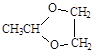 |
下列各组中的分子,全部是以极性键形成非极性分子的是
| A.H2、N2、Cl2 | B.CH4、NH3、H2O |
| C.HCl、NO、Br2 | D.CO2、CS2、CCl4 |
表中原子化热、晶格能、键能的单位都是kJ·mol-1
| 金属 | 金属原子化热 | 离子化合物 | 晶格能 | 共价键 | 键能 |
| Na | 108.4 | NaCl | 786 | Cl-Cl | 243 |
| Mg | 146.4 | NaBr | 747 | Si-Si | 176 |
| Al | 326.4 | MgO | 3791 | Si-Cl | 360 |
A.Na(s)与Cl2(g)反应生成1molNaCl(s)放出的热量为556.1kJ
B.Si(s)+2Cl2(g)=SiCl4(g) △H= - 602kJ·mol-1
C.从表中可以看出,氯化钠的熔点比晶体硅高
D.从表中数据可以看出,微粒半径越大金属键、离子键的越弱,而共价键却越强
能用键能知识解释的是
| A.稀有气体的化学性质很不活泼 | B.HCl气体比HI气体稳定 |
| C.干冰易升华 | D.HF熔沸点高于HCl |
某致基因突变物质的结构简式如图。下列相关分析正确的是
| A.电负性:C<N<O |
| B.该分子中σ键与π键数目之比为4:2 |
| C.该分子所有原子处于同一平面 |
D.该分子的加聚产物为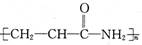 |
第28届国际地质大会提供的资料显示,海底有大量的天然气水合物,可满足人类1000年的能源需要。天然气水合物是一种晶体,晶体中平均每46个水分子构建成8个笼,每个笼可容纳1个CH4分子或1个游离H2O分子。下列关于天然气水合物中两种分子极性的描述正确的是 。
| A.两种都是极性分子 |
| B.两种都是非极性分子 |
| C.CH4是极性分子,H2O是非极性分子 |
| D.H2O是极性分子,CH4是非极性分子 |
下列分子的中心原子的杂化类型与其他不同的是
| A.SiCl4 | B.H2S | C.PCl5 | D.NH3 |